
分析 有A、B、C、D、E、F六种元素,它们位于前四周期,核电荷数依次增大,E元素的原子价电子构型为4s1,则E为K元素;F元素与E元素处于同一周期,其基态原子核外比E原子多10个电子,原子核外电子数为29,故F为Cu;A与E同主族,A与B形成的一种化合物的结构为正四面体形,则A为H元素,B处于第IVA族,B与D是同主族,则B为碳元素,D为Si;A与C按原子个数比为1:1或2:1形成化合物,B与C按原子个数比为1:1或1:2形成化合物,则C为O元素.
解答 解:有A、B、C、D、E、F六种元素,它们位于前四周期,核电荷数依次增大,E元素的原子价电子构型为4s1,则E为K元素;F元素与E元素处于同一周期,其基态原子核外比E原子多10个电子,原子核外电子数为29,故F为Cu;A与E同主族,A与B形成的一种化合物的结构为正四面体形,则A为H元素,B处于第IVA族,B与D是同主族,则B为碳元素,D为Si;A与C按原子个数比为1:1或2:1形成化合物,B与C按原子个数比为1:1或1:2形成化合物,则C为O元素.
(1)同周期随原子序数增大元素第一电离能呈增大趋势,同主族自上而下元素第一电离能减小,故B(碳)、C(氧)、D(Si)、E(K)四种元素的第一电离能由大到小的排列顺序:O>C>Si>K,
故答案为:O>C>Si>K;
(2)H3O+离子中O原子孤电子对数=$\frac{6-1-1×3}{2}$=1,价层电子对数=1+3=4,故立体构型为三角锥形,原子数目相等、价电子总数相等的微粒互为等电子体,与其互为等电子体的分子为:NH3,
故答案为:三角锥形;NH3;
(3)F为Cu元素,原子的基态电子排布式为:1s22s22p63s23p63d10 4s1,
故答案为:1s22s22p63s23p63d10 4s1;
(4)A与B可以形成分子式为H2C2的化合物,该分子为直线形对称结构,属于非极性分子,其结构式为H-C≡C-H,该分子中含有3个σ键,
故答案为:非极性;3.
点评 本题是对物质结构与性质的考查,涉及结构性质位置关系、电离能、空间构型、等电子体、核外电子排布、分子极性、化学键等,注意同周期第一电离能异常情况,熟练掌握常见化合物的组成与结构.


科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X元素形成的单核阴离子还原性强于Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种元素的原子序数依次递增.已知:
A、B、C、D、E、F六种元素的原子序数依次递增.已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
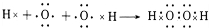
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
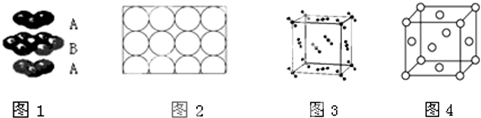
| A. | 钛和钾都采取图1的堆积方式 | |
| B. | 图2为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积 | |
| C. | 图3是干冰晶体的晶胞,晶胞棱长为a cm,则在每个CO2周围最近且等距离的CO2有8个 | |
| D. | 图4是一种金属晶体的晶胞,它是金属原子在三维空间以密置层采取ABCABC…堆积的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
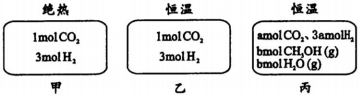
| A. | 刚开始反应时速率:甲>乙 | B. | 平衡后反应放热:甲>乙 | ||
| C. | 500℃下该反应平衡常数:K=3×102 | D. | 若a≠0,则0.9<b<l |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com