
我国发射的“神舟五号”载人飞船的燃料是铝粉与高氯酸铵的混合物.点燃时,铝粉氧化放热引发高氯酸铵反应2NH4ClO4=N2↑+4H2O+Cl2↑+O2↑;△H<0.关于该反应叙述不正确的是()
A. 该反应属于分解反应、氧化还原反应、放热反应
B. 该反应瞬间能产生大量高温气体,推动飞船飞行
C. 从能量变化上看,该反应是化学能转变为热能和动能
D. 反应中NH4ClO4只起到氧化剂的作用
考点: 氧化还原反应.
专题: 氧化还原反应专题.
分析: A、依据分解反应、氧化还原反应、放热反应的概念进行分析判断;
B、从能量守恒结合反应是放热反应进行分析判断;
C、依据化学反应的能量变化主要是热能,同时推进航天器升空产生了动能分析;
D、根据氧化剂和还原剂的概念分析.
解答: 解:A、符合一种物质生成两种或两种以上的物质的反应是分解反应,反应前后有元素化合价的变化是氧化还原反应,是放热反应,故A正确;
B、2NH4ClO4=N2↑+4H2O+Cl2↑+2O2↑;△H<0,反应热为负值则为放热反应,反应瞬间产生大量高温气体推动航天飞机飞行,故B正确;
C、该反应是放热反应,化学能转化为热能,推进航天器升空说明燃烧产生的热能转化为动能,故C正确;
D、反应NH4ClO4中N、O元素的化合价升高,被氧化作还原剂,Cl元素的化合价降低被还原作氧化剂,所以NH4ClO4既是氧化剂又是还原剂,故D错误;
故选D.
点评: 本题考查了反应类型的判断、化学反应与能量变化等,题目难度不大,注意把握氧化还原反应中氧化剂和还原剂的判断.


科目:高中化学 来源: 题型:
下列能用勒沙特列原理解释的是()
①红棕色NO2加压后颜色先变深后变浅
②SO2催化氧化成SO3的反应,往往加入过量的空气
③Fe(SCN)3溶液中加入固体KSCN后颜色变深
④氯水宜保存在低温、避光条件下
⑤乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利.
A. ①②⑤ B. ②③④ C. ①②③⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
以下是某课题组设计的由烃A合成聚酯类高分子材料.
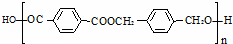 的路线:
的路线:
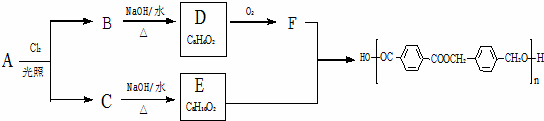
已知同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮.
根据以上信息回答:
(1)A的分子式 ,F中官能团的名称是 .
(2)化合物D的结构简式是 ,由B生成D的反应过程中生成的不稳定中间体的结构简式是 ,该中间体生成D的反应类型为 .
(3)E与F反应的化学方程式是 ,反应类型为 .与E具有相同官能团的含苯环的同分异构体有(写结构简式) 、、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()
A. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=﹣4b kJ/mol
B. C2H2(g)+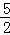 O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
C. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=2b kJ/mol
D. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的.”利用盖斯定律可测某些特别反应的热效应.
(1)P4(s,白磷)+5O2(g)=P4O10(s)△H1=﹣2983.2kJ/mol
(2)P(s,红磷)+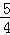 O2(g)=
O2(g)=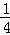 P4O10(s)△H2=﹣738.5kJ/mol
P4O10(s)△H2=﹣738.5kJ/mol
则白磷转化为红磷的热化学方程式 .相同的状况下,能量较低的是 ;白磷的稳定性比红磷 (填“高”或“低”).
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,取一定质量的硫酸铜溶液,用石墨做电极进行电解,当阳极产生标况下气体1.12L时,CuSO4恰好被完全电解,得到密度为1.2g•cm﹣3的溶液200mL.求:
(1)电解后所得溶液的为 .
(2)电解前所取CuSO4溶液的质量为 g.
(3)若要使电解后所得溶液恢复至电解前的原状态,需要加入何种物质(只要求写出一种),其化学式为CuO,加入物质的质量为 g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com