
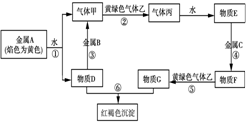
 现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、红褐色沉淀H,已知黄绿色气体乙为Cl2,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出),请根据以上信息回答下列问题:
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、红褐色沉淀H,已知黄绿色气体乙为Cl2,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出),请根据以上信息回答下列问题:分析 乙为黄绿色气体,乙为Cl2,H为红褐色沉淀,则H为Fe(OH)3,结合转化可知,则A为Na,D为为NaOH,B为Al,甲为H2,丙为HCl,E为盐酸,C为Fe,F为FeCl2,G为FeCl3,然后结合单质及化合物的性质、化学用语来解答.
解答 解:乙为黄绿色气体,乙为Cl2,H为红褐色沉淀,则H为Fe(OH)3,结合转化可知,则A为Na,D为为NaOH,B为Al,甲为H2,丙为HCl,E为盐酸,C为Fe,F为FeCl2,G为FeCl3,
(1)通过以上分析知,B、C、G、丙分别是Al、Fe、FeCl3、HCl,
故答案为:Al;Fe;FeCl3;HCl;
(2)钠和氧气加热生成过氧化钠,反应方程式为2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,
B的氧化物是氧化铝,氧化铝和NaOH溶液反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH-═2AlO2-+H2O;反应⑥的离子方程式为Fe3++3OH-═Fe(OH)3↓,
无机非金属性材料的主角是Si,与NaOH反应生成硅酸钠和氢气,反应方程式为Si+2NaOH+H2O=Na2SiO3+2H2↑;
物质E和C反应生成F反应方程式为2HCl+Fe=FeCl2+H2↑,氧化剂和还原剂的物质的量之比为2:1,
故答案为:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2;Al2O3+2OH-═2AlO2-+H2O;Fe3++3OH-═Fe(OH)3↓;Si+2NaOH+H2O=Na2SiO3+2H2↑;2:1;
(3)铁离子和硫氰根离子反应生成络合物硫氰化铁而使溶液呈血红色,所以看到的现象是溶液变红色,离子方程式为Fe3++3SCN-?Fe(SCN)3,故答案为:溶液变红色; Fe3++3SCN-?Fe(SCN)3.
点评 本题考查无机物的推断,为高频考点,明确物质性质特殊性是解本题关键,注意物质的颜色是解答的突破口,熟悉物质之间的转化,题目难度不大.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:解答题
 联合国气候变化大会于2009年12月7~18日在哥本哈根召开.中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.
联合国气候变化大会于2009年12月7~18日在哥本哈根召开.中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NH4+、NO3-、MnO4- | B. | Na+、NO3?、SO42?、I? | ||
| C. | K +、Fe3+、Cl-、Br- | D. | Ba2+、Na+、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某气体通入品红溶液中,能使其褪色,则该气体为二氧化硫 | |
| B. | 向Fe(NO3)2溶液中滴加稀盐酸溶液变成黄色 | |
| C. | 某无色溶液中加入盐酸酸化的BaCl2溶液有白色沉淀生成,则原溶液中含有SO42- | |
| D. | 钠在空气中燃料产物为白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食醋-C2H5OH | B. | 明矾-KAl(SO4)2 | C. | 苏打-NaHCO3 | D. | 生石灰-CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汤姆生 | B. | 卢瑟福 | C. | 玻尔 | D. | 道尔顿 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 Na2CO3溶液中:c(HCO3-)=2c(H2CO3)+c(H+)-c(OH-) | |
| B. | 物质的量浓度相等的Na2SO3和NaHSO3溶液中:3c(Na+)=2[c(HSO3-)+c(H2SO3)+c(SO32-)] | |
| C. | 同浓度的下列溶液中,①NH4HSO4 ②NH4Cl ③NH3•H2O,c(NH4+)由大到小的顺序是:②>①>③ | |
| D. | 常温下,浓度均为0.1mol/L NaA和HA溶液中pH=8:c(HA)>c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 等浓度的下列稀溶液:①硫酸氢钠 ②乙酸钠 ③醋酸 ④碳酸氢钠 ⑤硝酸钠 ⑥苯酚钠,它们的pH由小到大排列为:③⑤①④②⑥ | |
| C. | 常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中c (NH4+)由大到小的顺序是:②>①>④>③ | |
| D. | 在25℃时,将a mol•L-1的氨水与0.01 mol•L-1的盐酸等体积混合反应时溶液中c(NH4+)=c(Cl-).用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com