
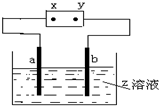
 如图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( )
如图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( ) | a极板 | b极板 | x电极 | Z溶液 | |
| A | 铜 | 银 | 负极 | CuCl2 |
| B | 石墨 | 石墨 | 正极 | NaOH |
| C | 铁 | 石墨 | 负极 | CuSO4 |
| D | 铜 | 银 | 正极 | AgNO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 该装置是电解池,通电后发现a极板质量增加,b极板处有无色无味的气体放出,说明a电极是阴极、b电极是阳极,阳极上氢氧根离子放电生成氧气,则阳极应该是惰性电极;阴极上析出金属,在金属活动性顺序表中该金属应该位于H元素之后,x是分解、y是正极,据此分析解答.
解答 解:该装置是电解池,通电后发现a极板质量增加,b极板处有无色无味的气体放出,说明a电极是阴极、b电极是阳极,阳极上氢氧根离子放电生成氧气,则阳极应该是惰性电极;阴极上析出金属,在金属活动性顺序表中该金属应该位于H元素之后,x是分解、y是正极,
A.Ag作阳极,阳极上Ag失电子生成银离子进入溶液,则阳极上不能生成氧气,故A错误;
B.x是负极、y是正极,不符合条件,故B错误;
C.x是负极,Fe是阴极、石墨是阳极,阳极上氢氧根离子放电生成氧气、阴极上铜离子放电生成Cu,所以符合条件,故C正确;
D.x是负极而不是正极,且银作阳极,阳极上Ag失电子生成银离子而不是生成氧气,不符合条件,故D错误;
故选C.
点评 本题考查电解原理,明确离子放电顺序及电极特点是解本题关键,注意:较活泼金属作阳极时,阳极上金属失电子而不是电解质溶液中阴离子失电子,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式和结构都相同,性质可能相同 | |
| B. | 分子式相同,结构不同,化学性质一定不相同 | |
| C. | 相对分子质量一定相同、官能团一定不同 | |
| D. | 相对分子质量和各元素质量分数一定相同,化学性质不一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中3个碳原子在同一直线上 | B. | 分子中所有原子在同一平面上 | ||
| C. | 与氯化氢加成只生成一种产物 | D. | 能发生加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 限制使用电动车 | |
| B. | 利用太阳能、风能和氢能等能源代替化石燃料 | |
| C. | 鼓励私人购买和使用汽车代替公交车 | |
| D. | 以煤等燃料作为主要生活燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素及其化合物的学习和应用是中学化学的主要任务之一.
元素及其化合物的学习和应用是中学化学的主要任务之一.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com