
 2SO3(g),当生成2molSO3时,反应放出的热量为197kJ。在相同温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时反应放出的热量为Q,则下列关系中正确的是()。
2SO3(g),当生成2molSO3时,反应放出的热量为197kJ。在相同温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时反应放出的热量为Q,则下列关系中正确的是()。科目:高中化学 来源: 题型:

 、
、 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是| c2(NH3) |
| c(N2).c3(H2) |
| c2(NH3) |
| c(N2).c3(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |

| OH- |
| H+ |
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6 ml | B、6.5 ml | C、7 ml | D、7.5 ml |
查看答案和解析>>
科目:高中化学 来源: 题型:
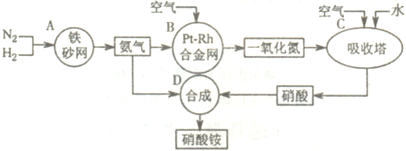
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com