
| A. | +3 | B. | +2 | C. | -2 | D. | +1 |
分析 Na2SO3还原2.4×10-3molXO(OH)2+到X元素的最终价态,则Na2SO3被氧化为Na2SO4,反应中S元素的化合价由+4价升高为+6价,令X元素在还原产物中的化合价为a,根据电子转移守恒计算a的值.
解答 解:Na2SO3还原2.4×10-3molXO(OH)2+到X元素的低价态,则Na2SO3被氧化为Na2SO4,反应中S元素的化合价由+4价升高为+6价,
令X元素在还原产物中的化合价为a,
由电子守恒可知,2.4×10-3mol×(5-a)=0.003L×0.2mol•L-1×(6-4),
解得a=+3,
故选A.
点评 本题考查氧化还原反应的有关计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,题目难度不大,注意计算中守恒思想的运用.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol•L-1氨水中,c(OH-)=c(NH4+) | |
| B. | 10 mL 0.02mol•L-1HCl溶液与10 mL 0.02mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 | |
| C. | 在0.1mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4、C6H6 | B. | CH4、CH2O | C. | C2H6、CH3CHO | D. | C3H8、CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钠溶于水与水反应后电离生成钠离子和氢氧根离子,因而氧化钠是非电解质 | |
| B. | NH3、SO3的水溶液均导电,所以NH3、SO3均是电解质 | |
| C. | 能电离出H+的化合物都是酸,能电离出OH-的化合物都是碱 | |
| D. | 液态HCl、固体NaCl均是电解质,但液态HCl和固体NaCl均不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
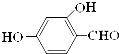 原儿茶醛是制造医药及染料的中间体,可用于制造多种抗菌素和消炎药物.其结构如图:请回答:
原儿茶醛是制造医药及染料的中间体,可用于制造多种抗菌素和消炎药物.其结构如图:请回答: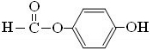 .
.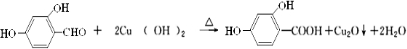 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com