
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 4×10-5 | 6×10-5 | 2×10-4 | 4×10-4 | 3×10-4 | 2×10-4 |
分析 (1)根据溶液中电荷守恒计算出氢离子浓度,再计算出溶液的pH;
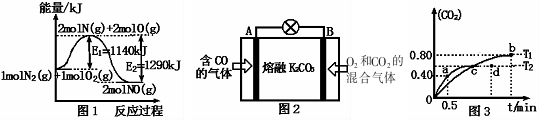
(2)①根据能量变化图计算反应热,反应热=反应物的键能和-生成物的键能和,从而书写热化学方程式;
②根据△G=△H-T•△S判断反应能否自发进行,如果△G<0,反应能自发进行,△G>0,反应不能自发进行;
③为燃料电池,CO在负极失去电子,据此书写电极反应方程式;
(3)亚硫酸氢钠与过量的氢氧化钙反应生成亚硫酸钙沉淀、水和氢氧化钠;
(4)①根据反应方程式写出该反应的化学平衡常数表达式;
②b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd.
解答 解:(1)溶液中存在电荷守恒:c(K+)+c(NH4+)+c(Na+)+c(H+)=2c(SO42-)+c(NO3-)+c(Cl-)+c(OH-),氢氧根离子浓度较小,可忽略不计,带入数据可知:c(H+)=1×10-3mol•L-1,该溶液的pH=3,
故答案为:3;
(2)①该反应中的反应热=反应物的键能和-生成物的键能和=1140-1290=-150kJ/mol,所以N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=-150kJ•mol-1,
故答案为:N2(g)+O2(g)=2NO(g)△H=-150kJ•mol-1;
②根据△G=△H-T•△S判断反应能否自发进行,如果△G<0,反应能自发进行,△G>0,反应不能自发进行,2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0,不能实现,
故答案为:否;该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0;
③此电池中电解质为熔融碳酸钾,负极CO失去电子,负极反应为:CO+CO32--2e-=2CO2,
故答案为:CO+CO32--2e-=2CO2;
(3)亚硫酸氢钠与过量氢氧化钙反应生成亚硫酸钙、氢氧化钠和水,反应的离子方程式为:HSO3-+OH-+Ca2+═CaSO3↓+H2O,
故答案为:HSO3-+OH-+Ca2+═CaSO3↓+H2O;
(4)①反应5CO(g)+I205(s)=5CO2(g)+I2(s)的平衡常数表达式为:K=$\frac{{c}^{5}(C{O}_{2})}{{c}^{5}(CO)}$,
故答案为:$\frac{{c}^{5}(C{O}_{2})}{{c}^{5}(CO)}$;
②b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,即K(T1)>K(T2),
故答案为:>.
点评 本题考查较为综合,涉及溶液pH的计算、原电池工作原理、热化学方程式书写、化学平衡常数等知识,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系及计算方法,明确原电池工作原理、热化学方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
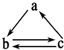 下表所列各组物质中,物质之间不能通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间不能通过一步反应就能实现如图所示转化的是( )| 物质 选项 | a | b | c |
| A | SiO2 | Na2SiO3 | H2SiO3 |
| B | C | CO | CO2 |
| C | Fe | FeCl2 | FeCl3 |
| D | CuO | Cu(OH)2 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池的正极反应式为H2+2OH--2e-═2H2O | |
| B. | 用铂电极电解硫酸铜溶液的阳极反应式为4OH--4e-═O2↑+2H2O | |
| C. | 表示醋酸与NaOH的稀溶液反应的中和热的化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ.mol-1 | |
| D. | NaHSO3溶于水时水解的离子方程式为HSO3-+H2O?SO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.3 mol•L-1 | D. | 0.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si可用于制造半导体材料 | |
| B. | 二氧化硫可广泛用于食品的增白 | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 84消毒液的有效成分是NaClO,可用于环境的消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b>c | B. | c>a>b | C. | b>a>c | D. | a>c>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁条燃烧可用泡沫灭火器灭火 | |
| B. | 工业上电解氯化钠、氯化镁溶液制取可以得到金属钠、镁 | |
| C. | 通常情况下,铁是银白色金属,硬度较大,可以被磁石吸引 | |
| D. | 铜能与氯化铁溶液反应,该反应可以用于印刷电路板的制作 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2不溶于水,但能溶于浓NH4Cl溶液中 | |
| B. | 水垢中含有的CaSO4,先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,再用酸除去 | |
| C. | 洗涤BaSO4沉淀时,用稀硫酸洗涤BaSO4沉淀比用蒸馏水洗涤损失少 | |
| D. | FeCl3溶液中混有FeCl2,常加入少量的H2O2,使Fe2+氧化为Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com