
|
取0.04molKMnO4固体加热一段时间后收集到amol气体,在反应后剩余的残留固体中加入足量的浓盐酸并加热,又收集到bmol气体,设此时Mn元素全部以Mn2+存在于溶液中,则a+b的最小值为 | |
| [ ] | |
A. |
0.04 |
B. |
0.08 |
C. |
0.10 |
D. |
0.20 |
科目:高中化学 来源: 题型:
| O | - 4 |
| O | - 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
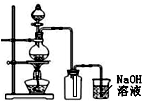 下列有关实验原理或操作正确的是( )
下列有关实验原理或操作正确的是( )| A、用广泛pH试纸测得0.1mol/LNH4Cl溶液的pH约为5 | B、10%的盐酸蒸发浓缩获得20%的盐酸 | C、称取0.4gNaOH,放入100mL容量瓶中,配制0.10mol/LNaOH溶液 | D、用二氧化锰和浓盐酸作试剂,按图装置制取少量Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com