
| A. | 某反应的焓变小于零,该反应一定能自发进行 | |
| B. | 用湿润的PH试纸测稀盐酸溶液的pH为3.52 | |
| C. | 原电池是将化学能转变为电能的装置 | |
| D. | 草木灰(K2CO3)是钾肥,硫酸铵是氮肥,两者混合施用可以提高肥效 |
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸盛放在玻璃试剂瓶中 | |
| B. | 浓硝酸盛在棕色试剂瓶中 | |
| C. | 氢氧化钠溶液盛在带橡皮塞的玻璃瓶中 | |
| D. | 氯水盛在棕色试剂瓶中,并放置在冷暗处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有0.1 mol•L-1 Fe3+的溶液中:H+、Fe2+、Na+、I- | |
| B. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| C. | 在pH=1的溶液中:Mg2+、Na+、ClO-、NO3- | |
| D. | 加入强碱再加热,既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
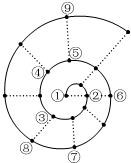 如果将前18号元素按原子序数递增的顺序排列,可形成图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中①点代表氢元素.下列有关说法正确的是( )
如果将前18号元素按原子序数递增的顺序排列,可形成图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中①点代表氢元素.下列有关说法正确的是( )| A. | 最简单气态氢化物的稳定性:③比⑧强、⑤比⑨弱 | |
| B. | 最高价氧化物对应水化物的碱性:②比⑥强 | |
| C. | ⑦的最高价氧化物对应的水化物具有两性 | |
| D. | 简单离子半径④比⑥小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图试管中盛有酸雨浸泡过的铁钉,U形管中盛有一段红墨水.开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升.下列说法不正确的是( )
如图试管中盛有酸雨浸泡过的铁钉,U形管中盛有一段红墨水.开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升.下列说法不正确的是( )| A. | 开始时发生的是析氢腐蚀 | B. | -段时间后发生的是吸氧腐蚀 | ||
| C. | 两段时间内负极的电极反应相同 | D. | 两段时间内正极的电极反应相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属镁在目前的汽车、航天、航空、机械制造、军事等产业中得判迅猛发展.
金属镁在目前的汽车、航天、航空、机械制造、军事等产业中得判迅猛发展.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
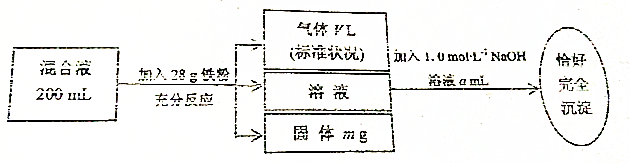
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com