
锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-===LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。

回答下列问题:
(1)LiCoO2中,Co元素的化合价为________ 。
。
(2)写出“正极碱浸”中发生反应的离子方程式__________________。
(3)“酸浸”一般在80 ℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式______________________________;可用盐酸代替H2SO4和H2O2的混合液,但缺点是________________。
(4)写出“沉钴”过程中发生反应的化学方程式_____________。
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式__________________________________。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是________________________________。在整个回收工艺中,可回收到的金属化合物有________________________________(填化学式)。
解析 (1)因锂在化合物中通常为+1价,故LiCoO2中Co为+3价。(2)由碱浸后经一系列处理可得到Al(OH)3及正极材料中含有铝箔知,碱浸时单质铝与NaOH溶液反应,由此可写出对应的离子方程式。(3)由流 程图知,钴元素最后变成+2价,故酸浸时发生的是LiCoO2氧化H2O2的反应:LiCoO2+H2SO4+H2O2―→Li2SO4+CoSO4+H2O+O2↑,配平即可。另外还存在H2O2受热分解生成水与O2的反应。用盐酸代替硫酸与H2O2的混合液时,会得到有毒的氧化产物Cl2,造成环境污染。(4)由流程图知,加入NH4HCO3后硫酸钴转化为碳酸钴,HCO
程图知,钴元素最后变成+2价,故酸浸时发生的是LiCoO2氧化H2O2的反应:LiCoO2+H2SO4+H2O2―→Li2SO4+CoSO4+H2O+O2↑,配平即可。另外还存在H2O2受热分解生成水与O2的反应。用盐酸代替硫酸与H2O2的混合液时,会得到有毒的氧化产物Cl2,造成环境污染。(4)由流程图知,加入NH4HCO3后硫酸钴转化为碳酸钴,HCO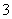 在转化为CoCO3的过程中,电离出的H+会与另外一部分HCO
在转化为CoCO3的过程中,电离出的H+会与另外一部分HCO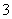 作用生成CO2与水,NH
作用生成CO2与水,NH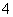 、SO
、SO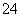 结合为(NH4)2SO4,由此可写出对应的化学方程式。(5)由充电时阴极(题目中锂离子电池的负极)的电极反应式知,放电时LixC6是反应物,Li+是生成物,锂的价态升高,故另一反应物中钴的价态降低,由此知该反应物是Li1-xCoO2,相应的反应方程式为LixC6+Li1-xCoO2===LiCoO2+6C。(6)放电时,负极上的锂失去电子变成Li+,进入溶液后再向正极移动并进入正极材料中,相当于在正极上富集了锂。由流程图知,能回收的金属化合物有三种。
结合为(NH4)2SO4,由此可写出对应的化学方程式。(5)由充电时阴极(题目中锂离子电池的负极)的电极反应式知,放电时LixC6是反应物,Li+是生成物,锂的价态升高,故另一反应物中钴的价态降低,由此知该反应物是Li1-xCoO2,相应的反应方程式为LixC6+Li1-xCoO2===LiCoO2+6C。(6)放电时,负极上的锂失去电子变成Li+,进入溶液后再向正极移动并进入正极材料中,相当于在正极上富集了锂。由流程图知,能回收的金属化合物有三种。
答案 (1)+3
(2)2Al+2OH-+6H2O===2Al(OH)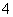 +3H2↑
+3H2↑
(3)2LiCoO2+3H2 SO4+H2O2
SO4+H2O2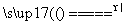 Li2SO4+2CoSO4+O2↑+4H2O、2H2O2
Li2SO4+2CoSO4+O2↑+4H2O、2H2O2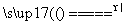 2H2O+O2↑ 有氯气生成,污染较大
2H2O+O2↑ 有氯气生成,污染较大
(4)CoSO4+2NH4HCO3===CoCO3↓+(NH4)2SO4+H2O+CO2↑
(5)Li1-xCoO2+LixC6===LiCoO2+6C
(6)Li+从负极中脱出,经由电解质向正极移动并进入正极材料中 Al(OH)3、CoCO3、Li2SO4


科目:高中化学 来源: 题型:
一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)zC(g)。该反应达到平衡后,测得A气体的浓度为0.5 mol·L-1。在恒温下将密闭容器体积扩大到原来的2倍,再次达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是( )
A.平衡向正反应方向移动
B.x+y<z
C.C的体积分数降低
D.B的转化率提高
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示的无机物的转化关系中,部分生成物和反应条件已略去。其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子。
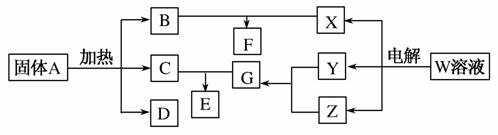

(1)写出X的电子式________;E中含有的化学键类型是________。
(2)Z与C以物质的量之比为31反应也能生成G,同时生成另一种二元化合物H,已知该反应中只有一种元素的化合价发生改变,则H的化学式为________。H大量用于面粉的漂白和消毒,它与水反应的化学方程式为___________________________________________________。
(3)将体积均为560 mL(标准状况)的B和Z同时缓缓通入水中,得到1.0 L溶液,则溶液中c(H+)=________mol/L。
(4)A~G七种物质中,属于电解质的有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机化合物的结构、性质的叙述正确的是( )
A.苯、油脂均能使酸性KMnO4溶液褪色
B.甲烷和Cl2的反应与乙烯和B r2的反应属于同一类型的反应
r2的反应属于同一类型的反应
C.蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体
D.乙醇、乙酸均能与NaOH溶液反应,因为分子中均含有官能团“—OH”
查看答案和解析>>
科目:高中化学 来源: 题型:
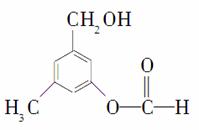
(2014·大连双基测试)有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )
①可以使酸性高锰酸钾溶液褪色 ②可以和NaOH溶液反应 ③在一定条件下可以和乙酸发生反应 ④在一定条件下可以发生消去反应 ⑤在一定条件下可以和新制Cu(OH)2反应
A.①②③ B.①②③④
C.①②③⑤ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
对于化学作为21世纪“中心学科”的理解是错误的是 ( )
A. 研制具有生物功能的材料制造人工器官 B. 把水变成汽油解决能源短缺的问题
C. 寻找更好的催化剂在常温常压下合成氨 D. 研究生命活动的物质揭示生命现象
查看答案和解析>>
科目:高中化学 来源: 题型:
在一支25 mL的酸式滴定管中盛入0.1 mol·L-1 HCl溶液,其液面恰好在5 mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.1 mol·L-1 NaOH溶液进行中和,则所需NaOH溶液的体积( )
A.大于20 mL B.小于20 mL C.等于20 mL D.等于5 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com