
 2C£ØĘų£©Čō¾ 2 Ćėŗó²āµĆ C µÄÅضČĪŖ0.6 mol”¤L£1 £¬ĻÖÓŠĻĀĮŠ¼øÖÖĖµ·Ø£ŗ¢ŁÓĆĪļÖŹ A ±ķŹ¾·“Ó¦µÄĘ½¾łĖŁĀŹĪŖ 0.3 mol”¤L£1”¤s£1¢ŚÓĆĪļÖŹ B ±ķŹ¾µÄ·“Ó¦µÄĘ½¾łĖŁĀŹĪŖ 0.6 mol”¤L£1”¤s£1¢Ū 2 s Ź±ĪļÖŹ A µÄ×Ŗ»ÆĀŹĪŖ30£„ ¢Ü 2 s Ź±ĪļÖŹ B µÄÅضČĪŖ 1.4 mol”¤L£1 £¬ĘäÖŠÕżČ·µÄŹĒ
2C£ØĘų£©Čō¾ 2 Ćėŗó²āµĆ C µÄÅضČĪŖ0.6 mol”¤L£1 £¬ĻÖÓŠĻĀĮŠ¼øÖÖĖµ·Ø£ŗ¢ŁÓĆĪļÖŹ A ±ķŹ¾·“Ó¦µÄĘ½¾łĖŁĀŹĪŖ 0.3 mol”¤L£1”¤s£1¢ŚÓĆĪļÖŹ B ±ķŹ¾µÄ·“Ó¦µÄĘ½¾łĖŁĀŹĪŖ 0.6 mol”¤L£1”¤s£1¢Ū 2 s Ź±ĪļÖŹ A µÄ×Ŗ»ÆĀŹĪŖ30£„ ¢Ü 2 s Ź±ĪļÖŹ B µÄÅضČĪŖ 1.4 mol”¤L£1 £¬ĘäÖŠÕżČ·µÄŹĒ| A£®¢Ł¢Ü | B£®¢Ł¢Ū | C£®¢Ś¢Ū | D£®¢Ū¢Ü |
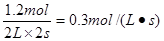 £¬ÓÉÓŚĖŁĀŹÖ®±ČŹĒĻąÓ¦µÄ»Æѧ¼ĘĮæŹżÖ®±Č£¬ĖłŅŌBµÄ·“Ó¦ĖŁĀŹÓ¦øĆŹĒ0.15mol/(L”¤s)”£“ĖŹ±AµÄ×Ŗ»ÆĀŹŹĒ
£¬ÓÉÓŚĖŁĀŹÖ®±ČŹĒĻąÓ¦µÄ»Æѧ¼ĘĮæŹżÖ®±Č£¬ĖłŅŌBµÄ·“Ó¦ĖŁĀŹÓ¦øĆŹĒ0.15mol/(L”¤s)”£“ĖŹ±AµÄ×Ŗ»ÆĀŹŹĒ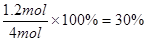 £¬BµÄÅØ¶ČŹĒ
£¬BµÄÅØ¶ČŹĒ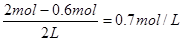 ”£ĖłŅŌ“š°øŃ”B”£
”£ĖłŅŌ“š°øŃ”B”£

 Ó®ŌŚæĪĢĆĆūŹ¦æĪŹ±¼Ę»®ĻµĮŠ“š°ø
Ó®ŌŚæĪĢĆĆūŹ¦æĪŹ±¼Ę»®ĻµĮŠ“š°ø ĢģĢģĻņÉĻæĪŹ±Ķ¬²½ŃµĮ·ĻµĮŠ“š°ø
ĢģĢģĻņÉĻæĪŹ±Ķ¬²½ŃµĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 2NO2 (g) ¦¤H<0£¬
2NO2 (g) ¦¤H<0£¬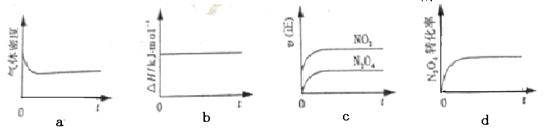
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Éś³É1molŅŅĖįŅŅõ„µÄĶ¬Ź±£¬Ņ²Éś³É1molŅŅĖį |
| B£®ŅŅĖį”¢ŅŅ“¼”¢ŅŅĖįŅŅõ„µÄÅضČĻąĶ¬ |
| C£®µ±ŅŅĖį¶ĻæŖ1molĢ¼Ńõµ„¼üµÄĶ¬Ź±£¬ŅŅ“¼Ņ²¶ĻæŖĮĖ1molĒāŃõ¼ü |
| D£®µ±ŅŅĖį¶ĻæŖ1molĒāŃõ¼üµÄĶ¬Ź±£¬ŅŅ“¼Ņ²¶ĻæŖĮĖ1molĢ¼Ńõµ„¼ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 2C(g)+xD(g)£¬¾5min“ļµ½Ę½ŗā£¬“ĖŹ±Éś³É2 mol C£¬²āµĆDµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.15 mol/(L”¤min)£¬ŌņĘ½ŗāŹ±AµÄĪļÖŹµÄĮæÅØ¶ČŹĒ____________£»BµÄ×Ŗ»ÆĀŹŹĒ__________£»xµÄÖµŹĒ___________”£
2C(g)+xD(g)£¬¾5min“ļµ½Ę½ŗā£¬“ĖŹ±Éś³É2 mol C£¬²āµĆDµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.15 mol/(L”¤min)£¬ŌņĘ½ŗāŹ±AµÄĪļÖŹµÄĮæÅØ¶ČŹĒ____________£»BµÄ×Ŗ»ÆĀŹŹĒ__________£»xµÄÖµŹĒ___________”£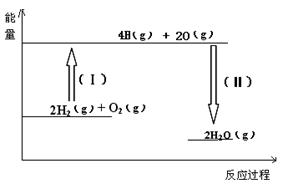
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
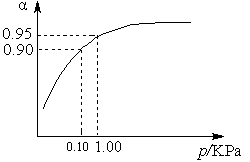
 2SO3(g) ¦¤H ="-98.3" kJ”¤mol-1”£
2SO3(g) ¦¤H ="-98.3" kJ”¤mol-1”£| ČŻ Ę÷ | ¼× | ŅŅ | ±ū |
| ·“Ó¦ĪļĶ¶ČėĮæ | 2 mol SO2”¢1 mol O2 | 2 mol SO3 | m mol SO2”¢n mol O2”¢ p mol SO3 |
| c(SO3) /mol”¤L-1 | 1.4 | 1.4 | 1.4 |
| ÄÜĮæ±ä»Æ | ·Å³öa kJ | ĪüŹÕb kJ | ĪüŹÕc kJ |
| SO2»ņSO3µÄ×Ŗ»ÆĀŹ | ¦Į1 | ¦Į2 | 12.5% |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗŹµŃéĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 2NO2 (g)ŌŚĻĀĮŠ¹ż³ĢÖŠ·¢ÉśµÄ±ä»ÆĆčŹöÕżČ·µÄŹĒ
2NO2 (g)ŌŚĻĀĮŠ¹ż³ĢÖŠ·¢ÉśµÄ±ä»ÆĆčŹöÕżČ·µÄŹĒ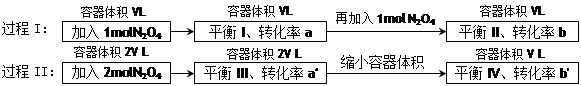
| A£®a' < b'”¢a > b | B£®ŌŚĘ½ŗāIĻņĘ½ŗāII¹ż¶ÉµÄ¹ż³ĢÖŠ£¬v(Äę) < v(Õż) |
| C£®a' > a”¢b' < b | D£®Ę½ŗāIIÓėĘ½ŗāIVÖŠN2O4µÄÖŹĮæ·ÖŹżĻąµČ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā



 ”÷H= £49.0 kJ£Æmol£¬²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĻĀĶ¼ĖłŹ¾”£Ēė»Ų“š
”÷H= £49.0 kJ£Æmol£¬²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĻĀĶ¼ĖłŹ¾”£Ēė»Ų“š £ŗ
£ŗ
 ŌŚĒ°10minÄŚ£¬ÓĆCO2±ķŹ¾µÄ·“Ó¦ĖŁĀŹ
ŌŚĒ°10minÄŚ£¬ÓĆCO2±ķŹ¾µÄ·“Ó¦ĖŁĀŹ (CO2)="________"
(CO2)="________"  a£®ČŻĘ÷Ń¹Ēæ²»±ä b£®»ģŗĻĘųĢåÖŠc(CO2)²»±ä
a£®ČŻĘ÷Ń¹Ēæ²»±ä b£®»ģŗĻĘųĢåÖŠc(CO2)²»±ä (CH3OH)=
(CH3OH)=  (H2O) d£®c(CH3
(H2O) d£®c(CH3 OH)=c(H2O)
OH)=c(H2O) (3)ĪŖĮĖĢįøßH2µÄ×Ŗ»ÆĀŹ£¬æɲÉČ”__________(Ģī”°Ōö“ó”±»ņ”°¼õŠ””±)CO2ÅØ¶ČµÄ“ėŹ©”£
(3)ĪŖĮĖĢįøßH2µÄ×Ŗ»ÆĀŹ£¬æɲÉČ”__________(Ģī”°Ōö“ó”±»ņ”°¼õŠ””±)CO2ÅØ¶ČµÄ“ėŹ©”£²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com