
科目:高中化学 来源:不详 题型:单选题
| A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 |
| B.电离能最小的电子能量最高 |
| C.同是s能级,在不同的电子层中所能容纳的最多电子数是不相同的 |
| D.核外电子排布完全相同的两种微粒,其化学性质一定相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na+ < Mg2+ < Al3+ < F- | B.S2-< Cl-< Na+ < Al3+ |
| C.Na > Mg > Al > S | D.Cs < Rb < K < Na |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.三者原子半径大小顺序为X>Y>Z |
| B.分子组成为Y5Z12的物质一定为纯净物 |
| C.1.5molX2与2molY恰好完全反应时,可得到相同物质的量的两种氧化物 |
| D.实验室用Z2X2为原料可以制备X2,每转移2mol电子,得到22.4LX2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
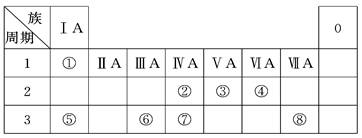
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3===3H3PO4+H2W↑ |
| 1 | | |
| 2 | | |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com