
| A. | 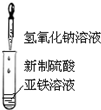 制备氢氧化亚铁并观察其颜色 | B. | 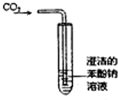 碳酸、苯酚酸性强弱比较 | ||
| C. | 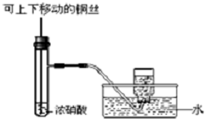 制备并收集少量NO2气体 | D. | 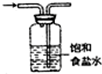 除去氯气中氯化氢 |
分析 A.氢氧化亚铁易被氧化生成氢氧化铁,所以制取氢氧化亚铁时要隔绝空气;
B.强酸能和弱酸盐反应生成弱酸;
C.二氧化氮和水反应生成硝酸和NO;
D.洗气装置中导气管要遵循“长进短出”原则.
解答 解:A.氢氧化亚铁易被氧化生成氢氧化铁,所以制取氢氧化亚铁时要隔绝空气,则胶头滴管要伸入液面下,故A错误;
B.强酸能和弱酸盐反应生成弱酸,二氧化碳和水反应生成碳酸,碳酸和苯酚钠反应生成苯酚沉淀,所以能实现实验目的,故B正确;
C.二氧化氮和水反应生成硝酸和NO,二氧化氮和空气不反应,所以应该采用排空气法收集,故C错误;
D.洗气装置中导气管要遵循“长进短出”原则,故D错误;
故选B.
点评 本题考查实验方案评价,为高频考点,涉及物质制备、物质性质检验、气体的净化和收集,明确实验原理是解本题关键,会根据气体的密度、性质确定收集方法,易错选项是A.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
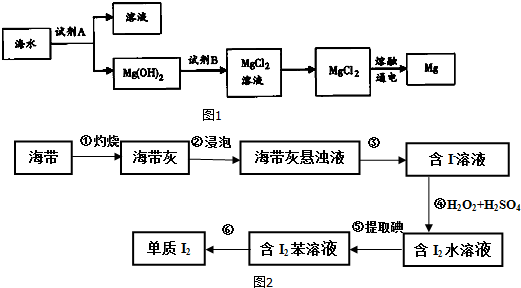
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应为吸热反应 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 该反应不需要加热就能进行 | |
| D. | 若此反应过程中有电子转移,可设计成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
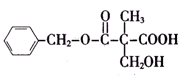
| A. | A不能和新制Cu(OH)2悬浊液反应 | |
| B. | A中含有2种含氧官能团 | |
| C. | A能够发生加成、取代和消去反应 | |
| D. | 1molA和足量的NaOH溶液反应,消耗2molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 解释或实验结论 |
| (1)纯净的A为无色粘稠液体, 易溶于水,沸点为380.4℃ | (1)将A从它的水溶液里分离出来 的操作方法是蒸馏. |
| (2)将13.6gA在20.0L纯O2(过量)中充分燃烧 并使反应后的气体依次缓缓通过浓硫酸和碱石灰后, 测得气体体积分别为17.76L和6.56L (所有气体体积均在标准状况下测定). | (2)A的实验式为C5H12O4, A的分子式为C5H12O4. |
(3)A的核磁共振氢谱如图: | (3)A中含有2种氢原 子,A的键线式为 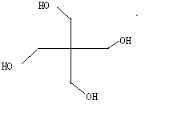 . . |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多 | |
| B. | 甲、乙氢氧化物溶液的碱性:甲>乙 | |
| C. | 乙能与盐酸反应放出H2,而甲不能 | |
| D. | 将甲、乙作电极组成原电池时,甲为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解法、热分解法、热还原法 | B. | 热分解法、电解法、热还原法 | ||
| C. | 热还原法、热分解法、热还原法 | D. | 电解法、电解法、热分解法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com