
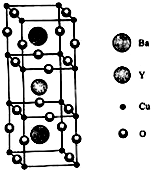
 铜族元素包括Cu、Ag、Au,其单质均为面心立方晶体.
铜族元素包括Cu、Ag、Au,其单质均为面心立方晶体.分析 (1)Au是第IB族元素,与Cu是同族,Cu有1个未成对电子;Cu原子的外围电子排布是3d104s1,4s、3d能级各失去1个电子形成Cu2+;向Cu2+溶液中加入足量的氨水后,再加入无水乙醇,可析出一种配合物,该配合离子是[Cu(NH3)4]2+,为深蓝色离子,其中N原子与3个H原子形成3个共价键,与铜离子形成配位键,N原子杂化轨道数目为4;
(2)根据均摊法计算晶胞中O原子数目为2,结合化学式可知Cu原子数目为4;Cu原子与位于体心的O原子与顶点的O原子之间,形成共价键,所以每个O原子与4个Cu原子形成共价键;
(3)根据均摊法计算晶胞中Y、Ba、Cu、O原子数目,进而确定化学式;根据化合价代数和计算+2价的Cu、+3价的Cu原子数目;Y的价电子排布式为4d15s2,有5个电子层,价电子数目为3,在元素周期表中第5周期第ⅢB族元素;
(4)Ag是面心立方晶胞,体积均摊法可知晶胞内有4个Ag原子,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)Au是第IB族元素,与Cu是同族,Cu有1个未成对电子,则Au也有1个未成对电子;Cu原子的外围电子排布是3d104s1,4s、3d能级各失去1个电子形成Cu2+形成Cu2+,则Cu2+的电子排布式为[Ar]3d9,向Cu2+溶液中加入足量的氨水后,再加入无水乙醇,可析出一种配合物,该配合离子是[Cu(NH3)4]2+,为深蓝色离子,其中N原子与3个H原子形成3个共价键,与铜离子形成配位键,所以N原子的杂化方式是sp3杂化,
故答案为:1;[Ar]3d9 ;sp3杂化;深蓝色;
(2)根据O原子的位置,可知晶胞中O原子的数目是8×$\frac{1}{8}$+1=2,在Cu2O中,Cu原子是O原子的数目的2倍,所以晶胞中Cu原子的数目是4;Cu原子与位于体心的O原子与顶点的O原子之间,形成共价键,所以每个O原子与4个Cu原子形成共价键,则O原子的配位数是4,
故答案为:4;4;
(3)Y原子位于体心,所以晶胞内Y原子的个数是1;Ba位于体内,则Ba原子的个数是2,Cu原子位于顶点和棱,则Cu原子的个数是8×$\frac{1}{4}$+8×$\frac{1}{8}$=3;O原子位于棱和面上,所以O原子的个数是12×$\frac{1}{4}$+8×$\frac{1}{2}$=7,则该晶胞的化学式是YBa2Cu3O7;该晶体中Y为+3,Ba为+2,铜为+2、+3,O为-2价,根据元素的正负化合价代数和为0的原则,则Cu元素的整体化合价为+7价,+2价的Cu有2个,+3价的Cu有1个,铜元素中+2价铜的百分含量为$\frac{2}{3}$;Y的价电子排布式为4d15s2,有5个电子层,价电子数目为3,Y是元素周期表中第5周期第ⅢB族元素,
故答案为:YBa2Cu3O7;$\frac{2}{3}$;第5周期第ⅢB族;
(4)Ag是面心立方晶胞,晶胞内Ag原子数目为6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,1nm=10-7cm,所以该晶胞的密度为$\frac{4×108}{{N}_{A}}$g÷(0.408×10-7cm)3=$\frac{4×108}{{N}_{A}×(0.408×1{0}^{-7})^{3}}$g•cm-3,
故答案为:$\frac{4×108}{{N}_{A}×(0.408×1{0}^{-7})^{3}}$.
点评 本题考查晶胞计算、核外电子排布、杂化方式判断等,注意掌握利用均摊法进行晶胞有关计算,难度中等.


科目:高中化学 来源: 题型:选择题
| A | B | C | ||
| D | E | F | G |
| A. | G的最高价氧化物对应的水化物是最强的酸 | |
| B. | 熔融电解化合物D2C3可制取单质D | |
| C. | F的最高价含氧酸的浓溶液与单质A共热时能生成三种氧化物 | |
| D. | A、G分别与氢元素形成的化合物中,化学键均为极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;C的化学名称为2,3-二甲基-1,3-丁二烯.
;C的化学名称为2,3-二甲基-1,3-丁二烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
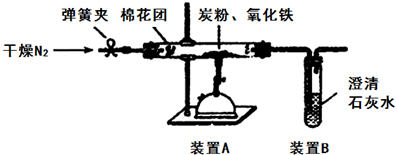
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
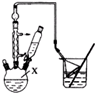 对叔丁基苯酚
对叔丁基苯酚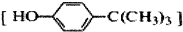 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下: .该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ | |
| B. | 由C(石墨,s)═C(金刚石,s)△H=+11.9 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H不同 | |
| D. | 任何一个化学变化都伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 紫色的石蕊试液中通入CO2后变色 | B. | SO2漂白草编制品 | ||
| C. | 木炭使红棕色的NO2气体褪色 | D. | 淀粉遇碘变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
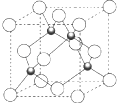 原子序数小于36 的X、Y、Z、W 四种元素,其中X 形成的单质是最轻的物质,Y 原子基态时最外层电子数是其内层电子数的2 倍,Z 原子基态时2p 原子轨道上有3 个未成对的电子,W 的原子序数为29.回答下列问题:
原子序数小于36 的X、Y、Z、W 四种元素,其中X 形成的单质是最轻的物质,Y 原子基态时最外层电子数是其内层电子数的2 倍,Z 原子基态时2p 原子轨道上有3 个未成对的电子,W 的原子序数为29.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com