
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液。整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是
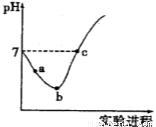
A.实验进程中可用pH试纸测定溶液的pH
B.向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强
C.c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D.由a点到b点的过程中,溶液中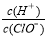 减小
减小
科目:高中化学 来源:2014-2015学年黑龙江省高三下学期第一次模考化学试卷(解析版) 题型:选择题
下列溶液中微粒的物质的量浓度关系正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液:c(H+)= c(OH-)= c(NH )=c(Cl-)
)=c(Cl-)
B.0.1 mol/L Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S)
C.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
D.常温下,pH=2的CH3COOH与pH=12的NaOH等体积混合:c (CH3COO-)+ c(H+)>c(Na+)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市房山区高三一模理综化学试卷(解析版) 题型:实验题
(15分)资料显示:a.Na2S2O3、BaS2O3、BaS均易溶于水。
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3。
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究:
实验制备装置如下图所示(省略夹持装置):
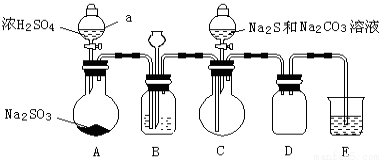
回答问题:
(1)仪器a的名称是 。
(2)装置A中发生反应的化学方程式是 。
(3)装置B的作用之一是观察SO2的生成速率。
①B中最好盛装的液体是 。
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液
d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是_________。
(4)在装置C中生成Na2S2O3。
①完成反应方程式: SO2 + Na2S + Na2CO3 = Na2S2O3 +
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是 。
③结束反应后,取C中溶液,经________、结晶、过滤、洗涤、干燥、得到Na2S2O3·5H2O。
(5)完成对所得产品的检测的实验:
推测 | 操作和现象 | 结论 |
杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生。 ④向滤液滴加2滴淀粉溶液,再逐滴加0.100 0 mol·L-1碘的标准溶液,至溶液呈紫色不再褪去,消耗碘的标准溶液体积为18.10mL。 | 产品杂质中: 一定含有 , 可能含有 , 一定不含有 。 操作④发生的反应是: 2S2O32-+I2===S4O 产品纯度: 。 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省台州市高三3月调研考试理综化学试卷(解析版) 题型:选择题
化学镀铜废液中含有一定量的CuSO4,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过。已知:①Cu2+ + HCHO + 3OH-=Cu + HCOO-+ 2H2O;②还原性:HCHO > M(—种金属)> Cu。
下列说法正确的是
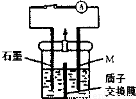
A.反应之前,应将含OH-的HCHO溶液加人到装置的左侧
B.右侧发生的电极反应式:HCHO-2e-+ H2O = HCOO- + 3H+
C.若将质子交换膜换成阴离子交换膜,放电过程中,大量的OH-将向左侧迁移
D.放电一段时间后打开开关,移去质子交换膜,装置中可能会有红色固体、蓝色絮状物出现
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省洛阳市高三第二次统一考试理综化学试卷(解析版) 题型:填空题
【化学—选修2:有机化学基础】(15分)水是一种重要的自然资源,是人类赖以生存不可缺少的物质。请回答下列问题:
(1)水质优劣直接影响人体健康。天然水在净化处理过程中加入的混凝剂可以是_____________(填两种物质的名称),其净水作用的原理是_________________________。
(2)水的净化与软化的区别是____________________________________。
(3)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO)。若某天然水中c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为_______________。
(4)若(3)中的天然水还含有c(HCO3-)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2_________g,后加入Na2CO3___________g。
(5)如图是电渗析法淡化海水的原理图。其中,电极A接直流电源的正极,电极B接直流电源的负极。
①隔膜A是_________离子交换膜(填“阴”或“阳”)。
②某种海水样品,经分析含有大量的Na+,Cl-,以及少量的K+,SO42-。若用上述装置对该海水进行淡化,当淡化工作完成后,A,B,C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省洛阳市高三第二次统一考试理综化学试卷(解析版) 题型:选择题
化学与生活密切相关,下列说法不正确的是
A.Fe2O3常用作红色油漆和涂料 B.氟氯烃是安全、环保的制冷剂
C.聚丙烯酸钠可做“尿不湿”原料 D.硅胶可用作瓶装药品干燥剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省韶关市高三调研考试理综化学试卷(解析版) 题型:选择题
部分弱电解质的电离平衡常数如下表:
弱电解质 | HCOOH | HCN | H2CO3 | NH3·H2O |
电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
下列说法不正确的是
A.结合H+的能力:CO32->CN->HCO3->HCOO-
B.0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-)
C.25 ℃时,pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水)
D.0.1mol/L的NaHCO3溶液中:c(Na+)+ c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一4月月考理科化学试卷(解析版) 题型:选择题
分离氯化铵和氯化钠的最佳方法是
A.加入烧碱 B.加热法
C.加入AgNO3溶液 D.利用溶解度不同,采用结晶法
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高二4月月考化学试卷(解析版) 题型:选择题
已知丙醇分子中的氧原子是18O,这种醇与乙酸反应生成酯的相对分子质量是
A.104 B.122 C.126 D.120
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com