
工业生产粗硅的反应有:
SiO2+2C ![]() Si(粗)+2CO↑;SiO2+3C
Si(粗)+2CO↑;SiO2+3C ![]() SiC+2CO↑。
SiC+2CO↑。
(1)若产品中粗硅与碳化硅的物质的量之比为1∶1,则参加反应的C 和SiO2的质量比为______________。
(2)粗硅进一步制备纯硅的原理如下:
Si(粗)+2Cl2(g) ![]() SiCl4(l); SiCl4+2H2
SiCl4(l); SiCl4+2H2 ![]() Si(纯)+4HCl。
Si(纯)+4HCl。
若上述反应中Si(粗)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂_______________吨。
(3)工业上还可以通过如下图所示的流程制取纯硅:
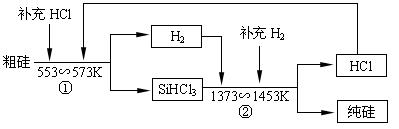
若反应①为:Si(粗)+3HCl(g)![]() SiHCl3(l)+H2(g);
SiHCl3(l)+H2(g);
则反应②的化学方程式为 ___________________________________ 。
假设每一轮次生产过程中,硅元素没有损失,反应①中HCl的利用率为α1,反应②中H2的利用率为α2,,若制备1mol纯硅,在第二轮次的生产中,现补充投入HCl和H2的物质的量之比是5∶1。则α1与α2的代数关系式为 ____________________________。
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
(10分)工业生产粗硅的反应有:
SiO2+2C Si(粗)+2CO↑;SiO2+3C
SiC+2CO↑。
(1)若产品中粗硅与碳化硅的物质的量之比为1∶1,则参加反应的C 和SiO2的质量比为______________。
(2)粗硅进一步制备纯硅的原理如下:
Si(粗)+2Cl2(g) SiCl4(l); SiCl4+2H2
Si(纯)+4HCl。
若上述反应中Si(粗)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂_______________吨。
(3)工业上还可以通过如下图所示的流程制取纯硅:
若反应①为:Si(粗)+3HCl(g)SiHCl3(l)+H2(g);
则反应②的化学方程式为 ___________________________________ 。
假设每一轮次生产过程中,硅元素没有损失,反应①中HCl的利用率为α1,反应②中H2的利用率为α2,,若制备1mol纯硅,在第二轮次的生产中,现补充投入HCl和H2的物质的量之比是5∶1。则α1与α2的代数关系式为____________________________。
查看答案和解析>>
科目:高中化学 来源:2011届江苏省苏锡常镇四市高三调研测试(一)化学试卷 题型:填空题
(10分)工业生产粗硅的反应有:
SiO2+2C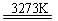 Si(粗)+2CO↑;SiO2+3C
Si(粗)+2CO↑;SiO2+3C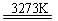 SiC+2CO↑。
SiC+2CO↑。
(1)若产品中粗硅与碳化硅的物质的量之比为1∶1,则参加反应的C 和SiO2的质量比为______________。
(2)粗硅进一步制备纯硅的原理如下:
Si(粗)+2Cl2(g) 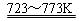 SiCl4(l); SiCl4+2H2
SiCl4(l); SiCl4+2H2  Si(纯)+4HCl。
Si(纯)+4HCl。
若上述反应中Si(粗 )和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂_______________吨。
)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂_______________吨。
(3)工业上还可以通过如下图所示的流程制取纯硅: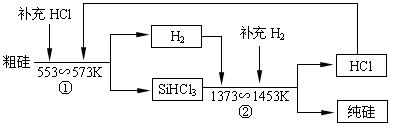
若反应①为:Si(粗)+3HCl(g)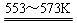 SiHCl3(l)+H2(g);
SiHCl3(l)+H2(g);
则反应②的化学方程式为___________________________________ 。
假设每一轮次生产过程中,硅元素没有损失,反应①中HCl的利用率为α1,反应②中H2的利用率为α2,,若制备1mol纯硅,在第二轮次的生产中,现补充投入HCl和H2的物质的量之比是5∶1。则α1与α2的代数关系式为____________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省邯郸市高三教学质量检测理综化学试卷(解析版) 题型:填空题
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)硅在元素周期表中的位置是_______。
(2)工业生产粗硅的反应有:SiO2+2C Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为
。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为
。
(3)工业上可以通过如下图所示的流程制取纯硅:

①若反应I为
Si(粗)+3HCl SiHCl3+H2,
SiHCl3+H2,
则反应II的化学方程式为 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另 一种物质,写出该反应的化学方程式: 。
③假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省苏锡常镇四市高三调研测试(一)化学试卷 题型:填空题
(10分)工业生产粗硅的反应有:
SiO2+2C 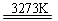 Si(粗)+2CO↑;SiO2+3C
Si(粗)+2CO↑;SiO2+3C 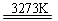 SiC+2CO↑。
SiC+2CO↑。
(1)若产品中粗硅与碳化硅的物质的量之比为1∶1,则参加反应的C 和SiO2的质量比为______________。
(2)粗硅进一步制备纯硅的原理如下:
Si(粗)+2Cl2(g) 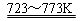 SiCl4(l);
SiCl4+2H2
SiCl4(l);
SiCl4+2H2 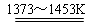 Si(纯)+4HCl。
Si(纯)+4HCl。
若上述反应中Si(粗)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂_______________吨。
(3)工业上还可以通过如下图所示的流程制取纯硅:

若反应①为:Si(粗)+3HCl(g)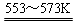 SiHCl3(l)+H2(g);
SiHCl3(l)+H2(g);
则反应②的化学方程式为 ___________________________________ 。
假设每一轮次生产过程中,硅元素没有损失,反应①中HCl的利用率为α1,反应②中H2的利用率为α2,,若制备1mol纯硅,在第二轮次的生产中,现补充投入HCl和H2的物质的量之比是5∶1。则α1与α2的代数关系式为 ____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com