
分析 (1)①硼酸是酸,能和碱发生中和反应;
②将浓度为0.1mol/L硼酸溶液加水不断稀释,电离平衡右移,电离出H+、[B(OH)4]-的物质的量增多,但浓度变小,结合电离平衡常数的表达式K=$\frac{c([B(OH)_{4}]^{-})•c({H}^{+})}{c({H}_{3}B{O}_{3})}$来分析.
③0.175mol/L硼酸溶液中K=$\frac{c([B(OH)_{4}]^{-})•c({H}^{+})}{c({H}_{3}B{O}_{3})}$,而c([B(OH)4]-)=c(H+),则c(H+)=$\sqrt{K•c({H}_{3}B{O}_{3})}$;
(2)根据25℃时,K(H3BO3)=5.72×10-10,Ka(HClO)=3×10-8,Ka(CH3COOH)=1.75×10-5,可知酸性CH3COOH>HClO>H3BO3,酸性越弱,电离程度越小,当pH相同时,其物质的量浓度越大,据此分析.
解答 解:(1)①硼酸是酸,能和碱发生中和反应生成盐和水,所以和氢氧化钠反应离子方程式为H3BO3+OH-=BO2-+2 H2O,
故答案为:H3BO3+OH-=BO2-+2 H2O;
②A.将浓度为0.1mol/L硼酸溶液加水不断稀释,电离平衡右移,电离出H+的物质的量增多,但c(H+)变小,且最后不变,故A错误;
B.Ka(H3BO3)只受温度的影响,加水稀释,K不变,故B错误;
C、加水稀释,c([B(OH)4]-)一直变小,c(H+)先变小后几乎不变,故c(OH-)先变大后几乎不变,则$\frac{c(O{H}^{-})}{c[B(OH)_{4}]^{-}}$ 一直变大,故C正确;
D.加水稀释,c([B(OH)4]-)变小,而电离平衡常数的表达式K=$\frac{c([B(OH)_{4}]^{-})•c({H}^{+})}{c({H}_{3}B{O}_{3})}$不变,故$\frac{c({H}^{+})}{c({H}_{3}B{O}_{3})}$变大,故D正确.
故答案为:CD;
③25℃时,0.175mol/L硼酸溶液中K=$\frac{c([B(OH)_{4}]^{-})•c({H}^{+})}{c({H}_{3}B{O}_{3})}$,而c([B(OH)4]-)=c(H+),故c(H+)=$\sqrt{K•c({H}_{3}B{O}_{3})}$=$\sqrt{5.72×1{0}^{-10}×0.175}$=10-5mol/L,则pH=5,故答案为:5;
(2)根据25℃时,K(H3BO3)=5.72×10-10,Ka(HClO)=3×10-8,Ka(CH3COOH)=1.75×10-5,可知酸性CH3COOH>HClO>H3BO3,酸性越弱,电离程度越小,当pH相同时,其物质的量浓度越大,故c(H3BO3)>c(HClO)>c(CH3COOH),由于等体积,则物质的量关系为n(H3BO3)>n(HClO)>n(CH3COOH),故消耗氢氧化钠的体积大小关系为V1>V2>V3,
故答案为:V1>V2>V3.
点评 本题考查了弱电解质的电离、电离常数的有关计算等,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握电离常数在计算中的应用方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
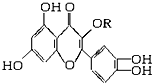 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A. | 1mol该物质可与5molNaOH发生反应 | |
| B. | 1mol该物质与足量溴水反应,最多消耗6molBr2 | |
| C. | 一定条件下1mol该物质可与H2加成,消耗H2最大量为6mol | |
| D. | 维生素P能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 | |
| B. | Na2O的水溶液能导电,不能说明Na2O是电解质 | |
| C. | 石英和玛瑙的主要成分均为二氧化硅,其分子式为SiO2 | |
| D. | 酸性氧化物大多数是非金属氧化物,因此不能与酸溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ①②④⑤⑥ | C. | ①④⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O和Na2O2的混合物共1mol,阴离子数目在NA~2NA之间 | |
| B. | 1mol OH-和1mol-OH (羟基)中含有的质子数均为9NA | |
| C. | 铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标准状况下) | |
| D. | 某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com