
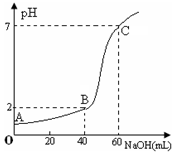
 常温下,取20mL某浓度的盐酸作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述不正确的是( )
常温下,取20mL某浓度的盐酸作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述不正确的是( )| A. | 所用盐酸的浓度是0.09mol•L─1,NaOH溶液浓度为0.03mol•L─1 | |
| B. | 在B点,溶液中离子浓度关系为:c(Cl─)>c(Na+)>c(OH-)>c(H+) | |
| C. | A、B、C三点水的电离程度大小依次为:C>B>A | |
| D. | 滴定前,锥形瓶用待测液润洗,导致盐酸浓度偏低 |
分析 A.设出盐酸和氢氧化钠溶液的物质的量浓度,然后根据图象中数据列式计算出盐酸和氢氧化钠溶液的浓度;
B.根据B点盐酸过量判断溶液中各离子的浓度大小;
C.A、B为酸性溶液,抑制了水的电离,氢离子浓度越大,水的电离程度越小,C点为中性,A、B、C中C点水的电离程度最大;
D.锥形瓶不能润洗,否则导致待测液中溶质的物质的量偏大,消耗的标准液体积偏大,测定结果偏高.
解答 解:A.设HCl的浓度是x mol/L,NaOH溶液浓度为y mol/L,结合图象则有:①20×10-3×x=60×10-3×y,②20×10-3×x-40×10-3×y=0.01×(20+40)×10-3,根据①②解得:x=0.09,y=0.03,即HCl的浓度是0.09mol•L-1,NaOH溶液浓度为0.03mol•L-1,故A正确;
B.在B点,盐酸过量,氢氧化钠溶液不足,溶液显酸性,则c(OH-)<c(H+),溶液中离子浓度大小关系为:c(Cl-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.在A、B、C三点溶液的酸性依次减弱,水的电离程度依次增大,则水的电离程度大小依次为:C>B>A,故C正确;
D.滴定前,锥形瓶用待测液润洗,导致溶液中氢离子的物质的量增加,滴定过程中消耗n(NaOH)增大,测定的HCl浓度偏高,故D错误;
故选D.
点评 本题考查了酸碱混合后溶液的定性判断及溶液pH的简单计算、水的电离及其影响因素、溶液中离子浓度定性比较等知识,题目难度中等,注意掌握比较溶液中离子浓度大小的方法,明确溶液酸碱性对水的电离程度的影响,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 可在分液漏斗内用四氯化碳萃取碘酒中的碘单质 | |
| B. | 放出下层液体时,应打开上方的玻璃塞,并使下端管口紧贴烧杯内壁 | |
| C. | 在分液漏斗中加入萃取剂后应上下颠倒摇匀使萃取剂与溶质充分接触 | |
| D. | 分液漏斗在使用前只需检查旋塞芯处是否漏水即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g氮气所含有的原子数目为NA | |
| B. | 16g O2中所含的氧原子数为NA | |
| C. | 标准状况下,22.4L水中含有NA个水分子 | |
| D. | 标准状况下,22.4L氯化氢所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X 中一定不存在Fe3O4 | B. | Y 中不一定存在MnO2 | ||
| C. | Z 溶液中一定含有Na2SO4 | D. | 不溶物Y 中一定含有Fe和CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c=$\frac{b}{11.2V}$ | B. | p=m+$\frac{{V}_{c}}{125}$ | C. | n=m+17Vc | D. | $\frac{17}{9}$m<p<$\frac{5}{3}$m |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol | B. | 4mol | C. | 6mol | D. | 8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| B. | 39g Na2O2与足量水充分反应时转移的电子数为0.5NA | |
| C. | 17 g羟基与17 g氨气所含电子数均为10NA | |
| D. | 1mol/L Na2SO4溶液中离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、NH4+、NH-的电子数相等,化学性质也相同 | |
| B. | 一定温度下液氨中c(NH4+)•c(NH2-)是一个常数 | |
| C. | 液氨的电离达到平衡时c(NH3)≠c(NH4+)=c(NH2-) | |
| D. | 加入其他物质,c(NH4+)/c(NH2-)可能不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com