
在硫酸铝、硫酸钾和明矾[KAl(SO4)2•12H2O]的混合溶液中,SO42﹣的浓度为0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解.则反应后溶液中K+的浓度约为( )
|
| A. | 0.225mol/L | B. | 0.25mol/L | C. | 0.45mol/L | D. | 0.9mol/L |
| 有关混合物反应的计算. | |
| 专题: | 守恒法. |
| 分析: | 根据当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解,求出原溶液中铝离子的浓度,根据电荷守恒计算原溶液中钾离子的浓度,再加上所加KOH的中钾离子的物质的量,可计算反应后钾离子的总浓度. |
| 解答: | 解:设体积均为1L,由于生成沉淀完全溶解,所以反应为 Al3++4OH﹣=AlO2﹣+2H2O 1 4 X 0.4mol 得x=0.1mol,即含有0.1molAl3+, 原溶液中只含有K+,Al3+和SO42﹣,根据电荷守恒,则 n(K+)+3n(Al3+)=2n(SO42﹣),而n(Al3+)=0.1mol,n(SO42﹣)=0.4mol, 所以n(K+)+3×0.1mol=2×0.4mol,得n(K+)=0.5mol, 而反应时又KOH引入了0.4molK+,所以K+总量为0.9mol,此时溶液体积变为2L,故c(K+)=0.45mol/L, 故选C. |
| 点评: | 本题考查有关混合物的计算,题目难度不大,注意根据质量守恒和电荷守恒的角度解答. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
某二种气态混合烃1L,完全燃烧后生成1.4L CO2和1.6L水蒸气(体积均在相同条件下测得),该混合烃是( )
|
| A. | 乙烷、乙炔 | B. | 甲烷、乙炔 | C. | 甲烷、丙炔 | D. | 乙烷、丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
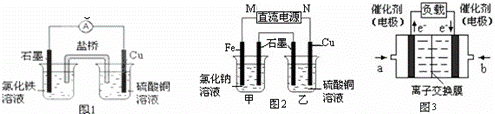
(1)图1装置发生反应的离子方程式为 .
(2)图2装置中甲烧杯盛放100mL 0.2mol•L﹣1的NaCl溶液,乙烧杯盛放100mL 0.5mol•L﹣1L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红.
①电源的M端为 极,甲烧杯中铁电极的电极反应为 .
②乙烧杯中电解反应的化学方程式为 .
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64g,甲烧杯中产生的气体标准状况下体积为 mL.
(3)图3是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 b处的电极反应式 ﹣ ,
甲醇燃料电池的总反应化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
将锌片和铜片按图示方式插入柠檬中,电流计指针发生偏转.下列针对该装置的说法正确的是( )
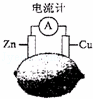
|
| A. | 将电能转换为化学能 | B. | 电子由铜片流出 |
|
| C. | 锌片是负极 | D. | 铜片逐渐被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
|
| A. | 金属汞洒落,必须尽可能收集起来,并将硫磺粉撒在洒落的地方,使金属汞转变成不挥发的硫化汞 |
|
| B. | 滴定管在使用前要用待装液润洗,而容量瓶不用润洗 |
|
| C. | AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 |
|
| D. | 碘单质与食盐的分离常用升华法,而碘水中提取碘单质则常用萃取法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
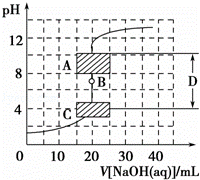
滴定法是中学化学中一种十分重要的定量分析方法.滴定法又可进一步分为酸碱中和滴定、氧化还原滴定等若干种.
强酸强碱中和滴定是一种准确度很高的定量分析的实验方法,其最主要的原因是:强酸强碱中和反应进行的很彻底,且在滴定过程中锥形瓶中混合溶液的pH变化通常如图所示,图中的点B称为 ,D区域称为 ,酸碱恰好中和时溶液的pH落在图中A段范围,则应选用的指示剂是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
以甲苯为原料可以合成某种食用香料(有机物G)和某种治疗肺结核药物的有效成分(有机物PAS-Na)的路线如下:
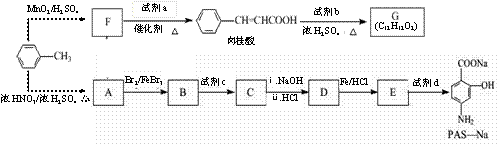 |
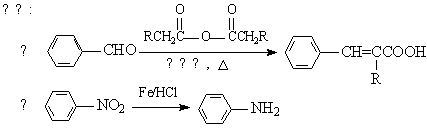
根据所给信息回答下列问题:
(1)肉桂酸不能够发生的反应类型有 ;
A.加成 B.消去 C.氧化 D,还原 E.取代 F.聚合
由B生成C的反应中新生成的官能团名称为 ;
(3)当试剂d过量时,可以选用的试剂d是 (填字母序号);
A.NaOH B.Na2CO3 C.NaHCO3
(4)A物质的名称为: ;试机a的结构简式为 ;
(5)质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,写出肉桂酸与试剂b生成G的化学方程式: ;
(6)写出C与NaOH反应的化学方程式符合下列条件的一共有 种。
①含有硝基官能团; ② 所有官能团都与苯环直接相连。
写出其中核磁共振氢谱上三组吸收峰的同分异构体的结构简式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容条件下化学反应:2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
ΔH=-Q kJ·mol-1在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
| 容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ·mol-1) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述正确的是( )
A.在上述条件下反应生成1 mol SO3固体放热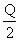 kJ
kJ
B.2Q3<2Q2=Q1<Q
C.Q1=2Q2=2Q3=Q
D.2Q2=2Q3<Q1<Q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com