
【题目】某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为![]() 。
。
阳离子 |
|
阴离子 |
|
甲同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在无色火焰上灼烧,未出现黄色火焰
②取少量溶液,加入![]() 溶液无明显变化。
溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入![]() 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
(1)步骤①使用的焰色反应属于___(填“物理”或“化学”)变化
(2)③中加入少量盐酸生成无色气体的离子方程式是____
(3)该溶液中一定含有的阳离子有___,一定含有的阴离子有___
(4)检验溶液中存在![]() 的方法是_____
的方法是_____
(5)取![]() 该溶液,向溶液中加入过量的稀氢氧化钠溶液,充分反应后,过滤、洗涤,将沉淀在空气中灼烧后得到的固体质量为___g
该溶液,向溶液中加入过量的稀氢氧化钠溶液,充分反应后,过滤、洗涤,将沉淀在空气中灼烧后得到的固体质量为___g
【答案】物理 ![]()
![]() 、
、![]()
![]() 、
、![]() 、
、![]() 取少量待测液于试管中,先加入稀盐酸,再加入
取少量待测液于试管中,先加入稀盐酸,再加入![]() 溶液,若产生白色沉淀,则含有
溶液,若产生白色沉淀,则含有![]() 12
12
【解析】
①用铂丝蘸取少量溶液,在无色火焰上灼烧,未出现黄色火焰,则溶液中无Na+;②取少量溶液,加入KSCN溶液无明显变化,则溶液中无Fe3+;③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,则溶液中含有NO3-和还原性离子,即Fe2+,此时溶液依然澄清,且溶液中阴离子种类不变,则溶液中含有Cl-;溶液中含有Fe2+,则CO32-、SiO32-不能存在;④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成,则存在SO42-。根据溶液呈电中性,且各离子的物质的量为1mol,即Fe2+、Cl-、NO3-、SO42-各0.1mol时,0.1×2+0.1x=0.1×1+0.1×1+0.1×2,x=2,则只能为Mg2+;
(1)步骤①灼烧时的焰色反应为元素所特有的性质,属于物理变化;
(2)溶液中的硝酸根离子、亚铁离子与氢离子反应生成铁离子、NO和水,反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(3)由分析可知,一定含有的阳离子为Fe2+、Mg2+;一定含有的阴离子有Cl-、NO3-、SO42-;
(4)检验SO42-常用盐酸和氯化钡溶液,方法是取少量待测液于试管中,先加入稀盐酸,取清液再加入BaCl2溶液,若产生白色沉淀,则含有SO42-;
(5)取1.0L该溶液,则溶液中含有0.1molFe2+、0.1mol Mg2+,向溶液中加入过量的稀氢氧化钠溶液,过滤、洗涤,将沉淀在空气中灼烧后,得到的固体为0.1molMgO、0.05molFe2O3,其质量为12g。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应:![]()
![]() 2SO3(g)。下列说法不正确的是
2SO3(g)。下列说法不正确的是
A. 改变反应条件可以改变该反应的限度
B. 达到平衡后,SO3、SO2、O2在密闭容器中共存
C. 达到平衡后,反应停止,正、逆反应速率都等于零
D. SO3、SO2、O2的浓度保持不变,说明该可逆反应达到了平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符合的是
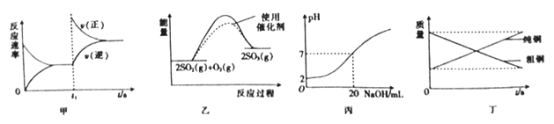
A.图甲表示t1时刻增加反应物浓度后v(正)和v(逆)随时间的变化
B.图乙表示反应2SO2(g)+O2(g)=2SO3(g) △H<0 在两种条件下物质能量随反应过程的变化
C.图丙表示25℃时用0.01mol/LNaOH溶液滴定20.00 mL 0.01mol/LHCl溶液时pH随NaOH 溶液体积的变化
D.图丁表示电解精炼铜时纯铜和粗铜的质量随时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积恒定的密闭容器中发生反应A(s)+2B(g)![]() C(g)+D(g)。下列不能说明反应一定达到化学平衡状态的是
C(g)+D(g)。下列不能说明反应一定达到化学平衡状态的是
A. v正(B)=2v逆(C) B. 每消耗1molC,同时生成1molD
C. 气体的密度保持不变 D. 容器内压强保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有 0.1 mol·L-1的 NH4HCO3 溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与 pH 的关系如下图所示。下列说法正确的是

A. 当溶液的 pH=9 时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3 ·H2O)>c(CO32-)
B. NH4HCO3 溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3)
C. 往该溶液中逐滴滴加氢氧化钠时,NH4+和 HCO3-浓度均逐渐减小
D. 通过分析可知常温下 Kb(NH3·H2O)大于 Ka1(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示A、B、C、D、E五种含氮物质相互转化的关系。其中A、B、C、D常温下都是气体,B为红棕色。
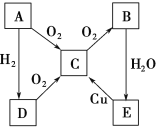
(1)写出下列物质的名称:
B________; E________。
(2)写出各步反应的化学方程式:
①A→C________________________________________;
②D→C________________________________________;
③C→B_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇被称为21世纪的新型燃料,研究和合成甲醇有着重要的意义。
(1)已知:①H2(g)+1/2O2(g)![]() H2O(l) ΔH1<0;②CO2(g)
H2O(l) ΔH1<0;②CO2(g)![]() CO(g)+1/2O2(g) ΔH2>0;③甲醇的燃烧热为ΔH3。试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)
CO(g)+1/2O2(g) ΔH2>0;③甲醇的燃烧热为ΔH3。试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)![]() CH3OH(l)的ΔH, 则ΔH=__kJ·mol-1。
CH3OH(l)的ΔH, 则ΔH=__kJ·mol-1。
(2)该方法生产甲醇是目前工业上常用的方法。在一定温度下,向2L密闭容器中充入1mol CO和2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g), 5分钟反应达平衡,此时CO的转化率为80%。请回答:
CH3OH(g), 5分钟反应达平衡,此时CO的转化率为80%。请回答:
①下列叙述合确的是__________(填编号)。
A.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动,c(CO)将变大
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和容积不变,再向容器中充入0.8mol CO和0.6mol CH3OH,则此时v正>v逆
②在方框的坐标系中画出甲醇的物质的量浓度随时间的变化曲线 ___________________
(3)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应Ⅱ: CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
控制CO2和H2初始投料比为1:3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图2所示。
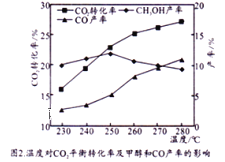
①由图2可知温度升高CO的产率上升,其主要原因可能是__________。
②由图2可知获取CH3OH最适宜的温度是_____。
(4)近几年开发的甲醇燃料电池的工作原理如图所示:
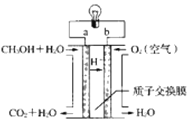
电池中的质子交换膜只允许质子和水分子通过,电解质溶液为稀硫酸,则a电极的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知反应:2A(l) ![]() B(l)
B(l) ![]() H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示。下列说法正确的是
H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示。下列说法正确的是
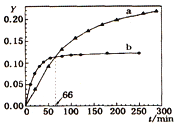
A.a代表20℃下A的Y-t曲线
B.反应到66min时,0℃和20℃下反应放出的热量相等
C.0℃和20℃下达到平衡时,反应都放出QkJ热量
D.反应都达到平衡后,正反应速率a > b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮物质等被广泛应用于化工、轻工、化肥、制药、合成纤维、塑料等行业中,是最重要的化工产品之一。
(一)发射卫星时可用N2H4为燃料,若用氟作氧化剂,已知:
![]()
![]()
![]()
![]()
![]()
![]()
则N2H4与F2反应的热化学方程式为:________。
(二)汽车尾气净化反应:![]() △H
△H
(1)该反应的逆反应速率随时间变化的关系如图:
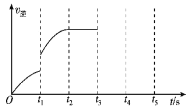
反应在t2时达平衡,在t1时改变了某种条件,改变的条件不可能是________。
A. 升温 B. 加压
C. 使用催化剂 D. 增大NO的浓度
(2)某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率及CO2的体积分数变化图如下:
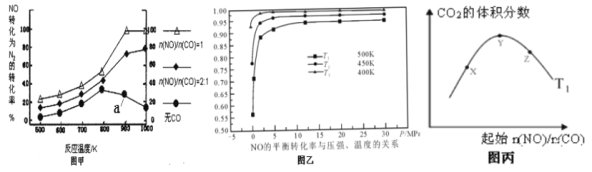
下列说法正确的是________。
A. 由图乙可得△H<0,反应低温自发
B. 为达到NO转化为N2的最佳转化率,应该选择的温度为900K,n(NO)/n(CO)=1
C. 图甲中对应的a点一定处于平衡状态
D. 图丙中X、Y、Z三点,CO的转化率由大到小的关系为Z>Y>X
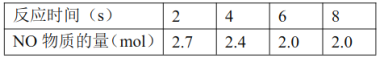
(3)向初始体积为4.5L的密闭容器中通入3molNO、1.5molCO,在恒压条件下发生反应:![]() ,平衡体系中NO的物质的量变化见下表。此温度下,该反应的平衡常数K=________。
,平衡体系中NO的物质的量变化见下表。此温度下,该反应的平衡常数K=________。
(三)尿素被广泛用作氮肥。
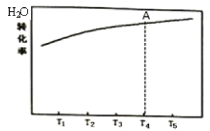
(1)在恒容的密闭容器中,发生反应![]() 。测得H2O的平衡转化率随温度的变化关系如图所示,已知T4时达平衡所需时间为t。请在图中画出反应经相同时间t时,H2O的转化率随温度变化的曲线。______________
。测得H2O的平衡转化率随温度的变化关系如图所示,已知T4时达平衡所需时间为t。请在图中画出反应经相同时间t时,H2O的转化率随温度变化的曲线。______________
(2)工业上可通过电解的方法处理尿素![]() 的碱性溶液,产物中无污染物,试写出电解时阳极的电极反应式________。
的碱性溶液,产物中无污染物,试写出电解时阳极的电极反应式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com