
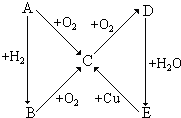
 根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质的化学式和有关反应的化学方程式.
根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质的化学式和有关反应的化学方程式.
| ||
| 高温高压 |
| ||
| ||
| △ |
| ||
| 高温高压 |
| ||
| ||
| △ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
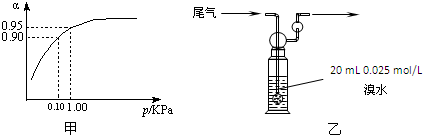
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol SO2、1mol O2 | 2mol SO3 | m mol SO2、n mol O2、 p mol SO3 |
| c(SO3)/mol?L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
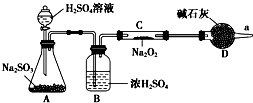 ①某学生根据SO2具有还原性判断SO2和Na2O2反应能生成硫酸钠,该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(A为SO2的发生装置,图中铁架台等装置已略去).
①某学生根据SO2具有还原性判断SO2和Na2O2反应能生成硫酸钠,该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(A为SO2的发生装置,图中铁架台等装置已略去).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com