
分析 (1)由反应CH4+4CuO=CO2+2H2O+4Cu,当甲烷完全反应后,硬质玻璃管的质量减轻9.6g,可知减少的质量为CuO中氧元素的质量,利用差量法计算甲烷的物质的量,再根据m=nM计算甲烷质量;
(2)将反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀8.5g为CaCO3的质量,可知二氧化碳总的物质的量,根据碳元素守恒计算原混合气体中二氧化碳物质的量,再计算氮气物质的量.
解答 解:(1)设甲烷的物质的量为x,当甲烷完全反应后,硬质玻璃管的质量减轻9.6g,则:
CH4+4CuO=CO2+2H2O+4Cu△m
1mol 16×4g
x 9.6g
所以x=$\frac{1mol×9.6g}{64g}$=0.15mol,
故甲烷的质量为0.15mol×16g/mol=2.4g
答:原混合气体中甲烷的质量2.4g;
(2)由反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀18g为CaCO3的质量,由C原子守恒可知:n总(CO2)=n(CaCO3)=$\frac{18g}{100g/mol}$=0.18mol,
根据碳原子守恒,则原混合气体中n(CO2)=0.18mol-0.15mol=0.03mol,
原混合气体的总物质的量为 $\frac{4.48L}{22.4L/mol}$=0.2mol,
所以氮气的物质的量为:0.2mol-0.15mol-0.03mol=0.02mol,
答:原混合气体中氮气的物质的量为0.02mol.
点评 本题考查化学反应方程式的计算,注意利用差量法、守恒法进行解答,难度不大,注意生成碳酸钙沉淀的二氧化碳来源.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=5的NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| B. | 在0.1mol•L-1 CH3COONa溶液中:n(OH-)+0.1mol>n(CH3COOH)+n(H+)+n(Na+) | |
| C. | 向AgBr的饱和溶液中加入NaCl固体,有白色固体析出,说明AgCl比AgBr更难溶 | |
| D. | 10mL 0.01mol•L-1 H2SO4溶液与10mL 0.01mol•L-1 NaOH溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
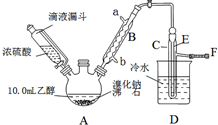 实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6 mol/(L•s) | B. | 0.16 mol/(L•s) | C. | 0.32mol/(L•s) | D. | 0.8 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②③④⑤⑧ | C. | ①②③⑥⑧ | D. | ②⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L盐酸 | B. | 0.01mol/L Na2CO3溶液 | ||
| C. | pH=4NaHSO3溶液 | D. | pH=11氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
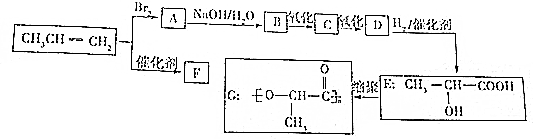
 .
.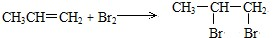 ,反应类型:加成反应;
,反应类型:加成反应;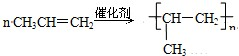 ,反应类型:加聚反应.
,反应类型:加聚反应.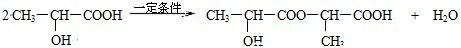 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com