
| A. | v(A)=0.5mol•L-1•s-1 | B. | v(B)=0.3mol•L-1•s-1 | ||
| C. | v(C)=0.8mol•L-1•s-1 | D. | v( D )=1.0mol•L-1•s-1 |
分析 同一可逆反应中,由于不同物质表示的速率之比等于化学计量数之比,故不同物质质表示的反应速率与其化学计量数的比值越大,则表示的反应速率越快,据此分析解答.
解答 解:同一可逆反应中,由于不同物质表示的速率之比等于化学计量数之比,故不同物质质表示的反应速率与其化学计量数的比值越大,则表示的反应速率越快,
A.$\frac{v(A)}{2}$=$\frac{0.5}{2}$ mol•L-1•s-1=0.25 mol•L-1•s-1;
B.$\frac{v(B)}{1}$=$\frac{0.3}{1}$mol•L-1•s-1=0.3mol•L-1•s-1;
C.$\frac{v(C)}{3}$=$\frac{0.8}{3}$mol•L-1•s-1=0.27mol•L-1•s-1;
D.$\frac{v(D)}{4}$=$\frac{1.0}{4}$mol•L-1•s-1=0.25mol•L-1•s-1;
通过以上分析知,反应速率与计量数之比的值大小顺序是B>C>A=D,所以反应速率最大的是B,故选B.
点评 本题考查化学反应速率大小比较,为高频考点,明确反应速率与计量数之间关系是解本题关键,注意单位要统一,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气是一种有强烈刺激气味的气体 | |
| B. | 氨气能被氧化为NO,是工业生产硝酸的重要原料之一 | |
| C. | 铵盐易和碱反应生成具有挥发性的氨气,在实验室中用NH4Cl和Ca(OH)2的混合物制取氨气 | |
| D. | 氨气极易溶于水,可用作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
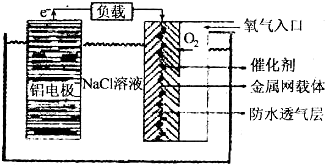
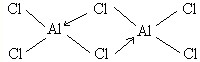 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有电子转移是氧化还原反应的本质,有元素化合价的变化是氧化还原反应的外观表现 | |
| B. | 一种物质被氧化,必然有另一种物质被还原 | |
| C. | 被氧化的物质得到或偏向电子,被还原的物质失去或偏离电子 | |
| D. | 氧化剂在反应中被氧化,还原剂在反应中被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com