
 中和热的测定实验(如图).
中和热的测定实验(如图).分析 (1)为了保证酸或是碱中的一方完全反应,往往保证一方过量;
(2)根据中和热测定的原理来分析;
(3)根据公式Q=△H=△Tcm来计算反应的焓变,并根据热化学方程式的书写方法来写热化学方程式;
(4)根据弱电解质电离吸热分析.
解答 解:(1)为了保证酸或是碱中的一方完全反应,往往保证一方过量,所以可以选择50mL 0.55mol•L-1 NaOH溶液,故答案为:B;
(2)在该实验过程中,该同学需要测定的实验数据有酸、碱的初始温度以及反应后混合溶液的终止温度,故答案为:BDF;
(3)反应放出的热量为Q=△Tcm=3.4°C×4.18J/(g•℃)×100g═1421.2J=1.42kJ,生成的水为0.025mol,△H=-Q/n(H2O)=-$\frac{1.42kJ}{0.025mol}$=-56.8KJ/mol,热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8KJ/mol;
故答案为:-56.8KJ/mol;HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8KJ/mol;
(4)醋酸为弱酸,电离过程为吸热过程,所以醋酸(CH3COOH)代替HCl溶液反应,反应放出偏小,故答案为:偏小.
点评 本题为有关中和热测定的实验知识考题,考查学生分析和解决问题的能力,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HCO3-、NO3- | B. | Na+、SO42-、Cl-、CO32- | ||
| C. | H+、Mg2+、SO42-、NO3- | D. | Ag+、K+、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
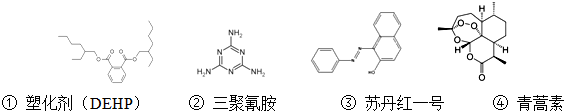
| A. | 塑化剂(DEHP)分子苯环上的二氯代物有六种不同的结构 | |
| B. | 三聚氰胺的分子式为C3N6H6 | |
| C. | 苏丹红一号分子中所有原子可能在同一平面上 | |
| D. | 青蒿素能够治疗疟疾可能与结构中存在过氧键基团有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
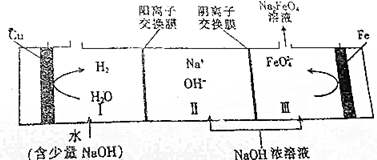
| A. | 电解时,铁棒连接电源的负极 | |
| B. | 铁棒的电极反应式为Fe+6e-+8OH-═FeO42-+4H2O | |
| C. | 若Ⅲ区生成1mol Na2FeO4,Ⅰ区将生成67.2L H2 | |
| D. | 电解总反应的离子方程式为Fe+2OH-+2H2O$\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )| A. | 电池工作时,B极反应式为O2+2H2O+4e-=4OH- | |
| B. | 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| C. | 试管中NaOH溶液用来吸收点解时产生的Cl2 | |
| D. | 当电池中消耗2.24L(标准状况)H2时,b极周围也会产生0.01mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 导电性强的溶液一定是强电解质溶液 | |
| B. | NaCl晶体由Na+和Cl-组成,NaCl晶体是电的良导体 | |
| C. | H2SO4是强电解质,稀硫酸中没有H2SO4分子 | |
| D. | pH=3是醋酸稀释至100倍,pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:
锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:| 序号 | 烧瓶中的物质 | 气体体积 | MnO2的作用 |
| 实验1 | 足量MnO2 | 56mL | |
| 实验2 | 足量MnO2和稀硫酸 | 112mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com