
【题目】室温下,将![]() mol
mol![]() 固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
A.加入50mL1![]() ,反应结束后,
,反应结束后,![]()
B.加入![]() molCaO,溶液中
molCaO,溶液中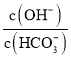 减小
减小
C.加入50mL![]() ,由水电离出的
,由水电离出的![]() 增大
增大
D.加入![]() mol
mol![]() 固体,反应完全后,溶液呈中性
固体,反应完全后,溶液呈中性
科目:高中化学 来源: 题型:
【题目】医用麻醉药苄佐卡因E和食品防腐剂J的合成路线如下:
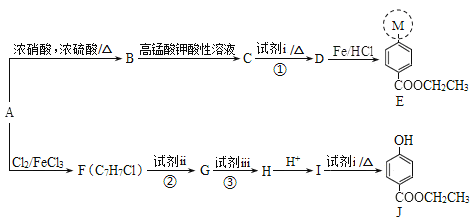
已知:I.M代表E分子结构中的一部分
II.![]()
请回答下列问题:
(1)E中含氧官能团的名称是___。
(2)A属于芳香烃,其结构简式是___。
(3)C能与NaHCO3溶液反应,反应①的化学方程式是___。
(4)反应②、③中试剂ii和试剂iii依次是____。(填序号)
a.高锰酸钾酸性溶液、氢氧化钠溶液 b.氢氧化钠溶液、高锰酸钾酸性溶液
(5)H的结构简式是___。
(6)J有多种同分异构体,其中符合下列条件的同分异构体有___种,写出其中任一种同分异构体的结构简式:___。
a.为苯的二元取代物,其中一个取代基为羟基
b.与J具有相同的官能团,且能发生银镜反应
(7)以A为起始原料,选用必要的无机试剂合成涂改液的主要成分亚甲基环己烷(![]() ),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___
),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知
时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知![]() 时硫酸钙的Ksp=9.1×10-6,下列说法正确的是( )
时硫酸钙的Ksp=9.1×10-6,下列说法正确的是( )
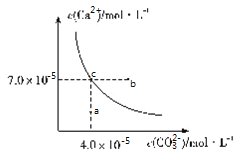
A.除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除
B.图中b点碳酸钙的结晶速率小于其溶解速率
C.通过蒸发,可使溶液由a点变化到c点
D.在25℃时,反应![]() 的平衡常数K=3500
的平衡常数K=3500
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。试回答下列问题:

(1)图中甲池通入O2极的电极反应式为____,通入CH3OH电极的电极反应式为______ 。
(2)若丙池中为饱和的MgCl2溶液,丙池中反应的离子方程式为__________。
(3)若c极的Pt电极换为Fe盐溶液为饱和食盐水,丙池中主要反应的离子方程式为___。
(4)若丙池装有1L 0.2 mol·L-1 CuSO4溶液,刚开始时,电极c的电极反应式为_______;电解一段时间后,向电解后的溶液中加入0.2mol碱式碳酸铜可使丙池恢复到原来的状态,则电路中转移电子的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲利用碳酸钠晶体(Na2CO3·10H2O)来配制0.5mol﹒L-1的碳酸钠溶液1000mL。回答下列问题
(1)需要称量碳酸钠晶体的质量为___________g,所选用容量瓶的规格为___________ mL。
(2)洗涤操作中,将洗涤烧杯后的溶液也注入容量瓶,其目的是__________________________________。
(3)定容的正确操作是继续加蒸馏水至离刻度线下1~2cm时,改用_________加水至液面与刻度线相切。
(4)用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是__________(填字母)。
a.重新配制
b.吸出多余液体,使凹液面与刻度线相切
c.经计算加入一定量的碳酸钠晶体
d.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
(5)配制时下列操作会导致所配溶液浓度偏高的是_____________(填字母)。
a.转传移时有少量溶液溅出
b.定容时俯视读取刻度
c.容量瓶用蒸馏水洗净后未干燥
d.定容时液面超过了刻度线
(6)从上述配制的溶液中取出10mL,其中含Na2CO3的质量是_____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为同一周期原子序数依次增大的短周期主族元素,已知A、B、D三种原子最外层共有10个电子,且这三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的核电荷数是最外层电子数的3倍。
(1)A的单质在空气中燃烧的产物为____填化学式)。
(2)D、E的最高价氧化物的水化物的酸性比较:_______ (用化学式表示)。
(3)元素E形成的单质通入D的一种氧化物的水溶液中发生反应,生成两种常见的强酸。该反应的化学方程式为____。
(4)写出B、A两元素的最高价氧化物的水化物相互反应的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)向含有Cr2O72-的酸性废水中滴加硫酸亚铁溶液生成Cr3+,反应的离子方程式为____
(2)FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+Fe2O3+CO2+NaNO2 该反应配平后FeO·Cr2O3与NaNO3的系数比为________________。
Na2CrO4+Fe2O3+CO2+NaNO2 该反应配平后FeO·Cr2O3与NaNO3的系数比为________________。
(3)FePO4、Li2CO3、H2C2O4混合后高温煅烧制LiFePO4的化学方程式为_____________
(4)用NaOH、H2O2的混合溶液吸收ClO2生产NaClO2,氧化剂与还原剂的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种主族元素(过渡元素略去)在周期表中的位置如下:
A | |||||||
M | B | D | |||||
E | G | R | J | ||||
T | |||||||
(1)E、G、T的原子半径由大到小的顺序是_____(填元素符号)。
(2)硒元素(34Se)与D同主族,其非金属性比D______(填“强”或“弱”)。
(3)E、G元素最高价氧化物对应水化物之间能反应,离子方程式为:_______。
(4)E、D两元素能形成原子个数比1:1 型化合物的电子式为________。
(5)A与M形成的分子可能是________(填字母序号)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com