
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A. 反应在0~3 s内的平均速率v(NO2)=0.24 mol·L-1·s-1
B. 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol·L-1,则反应的ΔH>0
C. 在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20%
D. 在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍
【答案】D
【解析】A.由表中数据可知,3s内压强物质的量变化量为0.36mol,容器体积为2L,故0~3s内v(O2)= 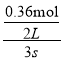 =0.06mol/(L.s),速率之比等于其化学计量数之比,故v(NO2)=2v(O2)=2×0.06mol/(L.s)=0.12mol/(L.s),故A错误;B.由表中数据可知,12s与24s时氧气的物质的量均为0.8mol,说明12s时可逆反应到达平衡,平衡时氧气的浓度为
=0.06mol/(L.s),速率之比等于其化学计量数之比,故v(NO2)=2v(O2)=2×0.06mol/(L.s)=0.12mol/(L.s),故A错误;B.由表中数据可知,12s与24s时氧气的物质的量均为0.8mol,说明12s时可逆反应到达平衡,平衡时氧气的浓度为![]() =0.4mol/L,降低温度,达到新平衡时测得c(O2)=0.44mol/L,氧气浓度增大,说明降低温度,平衡向正反应方向移动,则正反应为放热反应,即△H<0,故B错误;C.在T温度下,起始时向容器中充入2.0molN2O5和2.0molO2,转化到左边相当于起始投入4.0molNO2和2.0molO3,所到达的平衡状态相当于在原平衡的基础上压强增大一倍,平衡先正反应方向移动,平衡时N2O5的物质的量大于2×0.8mol=1.6mol,故参加反应的N2O5的物质的量小于2mol-1.6mol=0.4mol,则达到平衡时,N2O5的转化率小于
=0.4mol/L,降低温度,达到新平衡时测得c(O2)=0.44mol/L,氧气浓度增大,说明降低温度,平衡向正反应方向移动,则正反应为放热反应,即△H<0,故B错误;C.在T温度下,起始时向容器中充入2.0molN2O5和2.0molO2,转化到左边相当于起始投入4.0molNO2和2.0molO3,所到达的平衡状态相当于在原平衡的基础上压强增大一倍,平衡先正反应方向移动,平衡时N2O5的物质的量大于2×0.8mol=1.6mol,故参加反应的N2O5的物质的量小于2mol-1.6mol=0.4mol,则达到平衡时,N2O5的转化率小于![]() ×100%=20%,故C错误;D.容器体积不变,在T温度下,起始时向容器中充入1.0molNO2、0.5molO3和0.50molN2O5、0.50molO2,转化到左边相当于起始投入2.0molNO2和1.0molO3,与原平衡为完全等效平衡,平衡时压强相等,12s到达平衡时氧气的物质的量为0.8mol,则:
×100%=20%,故C错误;D.容器体积不变,在T温度下,起始时向容器中充入1.0molNO2、0.5molO3和0.50molN2O5、0.50molO2,转化到左边相当于起始投入2.0molNO2和1.0molO3,与原平衡为完全等效平衡,平衡时压强相等,12s到达平衡时氧气的物质的量为0.8mol,则:
2NO2(g)+O3(g)N2O5(g)+O2(g) 物质的量减少
1 1
0.8mol 0.8mol
故原平衡中平衡时气体物质的量为2mol+1mol-0.8mol=2.2mol,即起始时向容器中充入1.0molNO2、0.5molO3和0.50molN2O5、0.50molO2到达平衡时,混合气体总物质的量为2.2mol,平衡时压强为起始的![]() =0.88倍,故D正确;故选D。
=0.88倍,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】【2016上海卷】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。
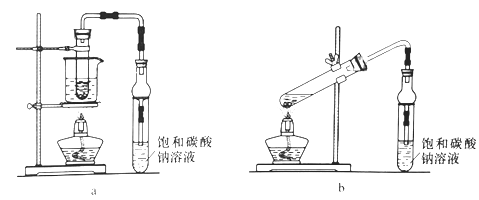
完成下列填空:
(1)实验时,通常加入过量的乙醇,原因是______________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______________;浓硫酸用量又不能过多,原因是____________。
(2)饱和Na2CO3溶液的作用是___________、_____________、_____________。
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,_________、________,然后分液。
(4)若用b装置制备乙酸乙酯,其缺点有__________、__________。由b装置制得的乙酸乙酯粗产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实际应用的原理表达式中,不正确的是( )
A. 用排饱和食盐水法收集Cl2:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B. 热的纯碱溶液碱性增强:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C. 向Mg(OH)2悬浊液中加入FeCl3溶液:3Mg(OH)2(s)+2Fe3+=2Fe(OH)3(s)+3Mg2+
D. 用TiCl4制备TiO2:TiCl4+(x+2)H2O(过量)![]() TiO2·x H2O↓+4HCl
TiO2·x H2O↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )

A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2molL-1的的KI溶液和0.05 molL-1Fe2(SO4)3溶液等体枳混合充分反应后,取混合液分别完成下列实验,能说明溶液中存在化学平衡2Fe3++2I-![]() 2 Fe2++I2的组合是
2 Fe2++I2的组合是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和② B. ②和③ C. ③和④ D. ①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以绕键轴自由旋转,结构简式为:![]() 的烃,下列说法正确的是( )
的烃,下列说法正确的是( )
A. 分子中至少有9个碳原子处于同一平面上
B. 分子中至少有11个碳原子处于同一平面上
C. 分子中至少有16个碳原子处于同一平面上
D. 该烃属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列事实不能说明NH3·H2O为弱电解质的是( )
A. 0.1 mol·L-1NH3·H2O的pH小于13
B. 0.1 mol·L-1NH4Cl溶液的pH小于7
C. 相同条件下,浓度均为0.1 mol·L-1NaOH溶液和氨水,氨水的导电能力弱
D. 0.1 mol·L-1NH3·H2O能使无色酚酞溶液变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将甲、乙两种液体混合,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的物质的量(n)与甲在混合液中的质量分数(x%)关系如图所示,则下列选项中甲、乙组合正确的是

A | B | C | D | |
甲 | 戊烯 | 已烯 | 已二炔(C6H6) | 已烷 |
乙 | 环已烷(C6H12) | 苯 | 苯 | 乙醇 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com