
 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是| A.Al2O3是氧化剂,C是还原剂 | B.每生成1molCO需转移2mol电子 |
| C.AlN中氮元素的化合价为+3 | D.AlN的摩尔质量为41 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.S2- | B.S | C.SO32- | D.SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5/16 | B.5/17 | C.5/13 | D.13/5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.方程式中产物CO2的计量数为6 |
| B.CO2是还原产物,ClO2是氧化产物 |
| C.氧化剂和还原剂的物质的量之比为4:1 |
| D.每生成1 mol CO2需转移24mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Fe3O4+6SO2,有3mol FeS2参加反应,转移 mol电子。
Fe3O4+6SO2,有3mol FeS2参加反应,转移 mol电子。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 HSO3- + H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3- + H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中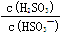 将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,
将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,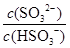 的值 ;加入少量水,水的电离程度将 。
的值 ;加入少量水,水的电离程度将 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.原混合酸中NO3-的物质的量为0.2 mol |
| B.原混合酸中H2SO4物质的量浓度为2mol/L |
| C.OA段与BC段反应中电子转移的物质的量之比为2:1 |
| D.取20mL原混合酸加水稀释至1L后溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.x=2 | B.Fe2+、S2O32-都是还原剂 |
| C.硫元素被氧化,铁元素被还原 | D.每生成1 mol Fe3O4,则转移电子的物质的量为3 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 。则下列判断错误的是.
。则下列判断错误的是.| A.该反应能在瞬间完成,并产生大量气体 |
| B.生成标准状况下2.24L气体,该反应转移电子的物质的量为0.5mol |
| C.该反应中的氧化剂为KNO3 |
| D.被氧化和被还原的N原子的物质的量之比为15:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com