
分析 (1)根据盖斯定律书写热化学反应方程式;
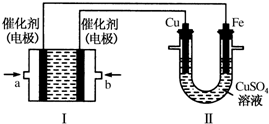
(2)①II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂;甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
②根据I中氢氧根离子浓度变化确定溶液pH变化;II中发生电镀,阳极上溶解的铜质量等于阴极上析出铜的质量;
③I中还有碳酸根离子生成;
④根据转移电子相等计算消失甲烷的体积.
解答 解:(1)CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=260kJ•mol-1①
2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1②,
将方程式2①+②得 2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46kJ•mol-1 ,
故答案为:2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46kJ•mol-1 ;
(2)①II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂,所以a处通入的气体是甲烷;甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应为CH4+10OH--8e-=CO32-+7H2O,
故答案为:CH4;CH4+10OH--8e-=CO32-+7H2O;
②根据I中电池反应为CH4+2O2+2KOH=K2CO3+3H2O,KOH参加反应导致溶液中KOH浓度降低,则溶液的pH减小;
II中发生电镀,阳极上溶解的铜质量等于阴极上析出铜的质量,则溶液中铜离子浓度不变,
故答案为:变小;不变;
③I中负极反应为CH4+10OH--8e-=CO32-+7H2O,所以还有碳酸根离子生成,故答案为:CO32-;
④串联电路中转移电子相等,所以消耗甲烷的体积=$\frac{\frac{12.8g}{64g/mol×2}}{8}$=1.12L,故答案为:1.12.
点评 本题考查了盖斯定律、原电池和电解池原理,根据电解池中Cu、Fe电极上发生的反应确定燃料电池中正负极及电极上通入的气体,再结合转移电子相等计算,难点是电极反应式的书写.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A. | 反应的化学方程式为:N?2M | |
| B. | t2时,正逆反应速率相等,达到平衡 | |
| C. | t3时,正反应速率等于逆反应速率 | |
| D. | t3后,若升高温度则反应速率不一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
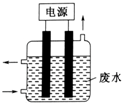
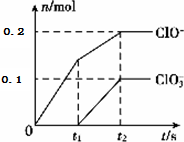
| A. | 该电解装置电极材料均为铁 | |
| B. | 除去CN-的反应:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O | |
| C. | 阴极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O | |
| D. | 该装置排放出的气体主要为N2和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


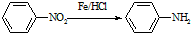 (苯胺,易被氧化)
(苯胺,易被氧化) ,F→G的反应类型是氧化反应.
,F→G的反应类型是氧化反应. .
. 的同分异构体的结构简式
的同分异构体的结构简式 .(写出2种)
.(写出2种) ,请设计合成路线,要求不超过4步(无机试剂任选).注:合成路线的书写格式参照如下示例流程图:CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4}}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
,请设计合成路线,要求不超过4步(无机试剂任选).注:合成路线的书写格式参照如下示例流程图:CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4}}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、NH4+、Cl-、CO32- | B. | Na+、CH3COO-、K+、HCO3- | ||
| C. | Fe2+、Cl-、Na+、NO3- | D. | K+、I-、CO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com