
【题目】足量的铜和含有2.4×10-3mol 硝酸的某浓硝酸完全反应,共收集到标准状况下气体的体积是22.4 mL。参加反应的铜的物质的量是( )
A. 0.6×10-3 molB. 0.7×10-3 mol
C. 0.75×10-3 molD. 0.9×10-3 mol
科目:高中化学 来源: 题型:
【题目】下列有关实验装置或操作进行的相应实验,能达到实验目的的是

A. 用图甲所示装置分离乙醇和碘的混合液
B. 用图乙所示操作配制100 mL 0.1 mol·L-1硫酸溶液
C. 用图丙所示装置制备氨气
D. 用图丁所示装置检验浓硫酸与蔗糖反应产生的二氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将充有m mLNO 和n mLNO2的量筒倒立于水槽中,然后通入m mL O2,若m<n,则充分反应后量筒内气体体积(mL)为( )
A. 3(m-n)B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜铁合金中铜和铁的物质的量之和为ymol,其中铜的物质的量分数为a,将其全部投入50mLbmol/L的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
A. 当溶液中金属离子只有铁离子和铜离子时,则a和b的关系为b≥80y(1-a/3)
B. 若金属有剩余,在溶液中再滴入硫酸后,金属不会溶解
C. 若金属全部溶解,则溶液中一定含有铁离子
D. 若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组的性质比较正确的是( )
A. 稳定性:NH3<PH3 < SiH4 B. 酸性:HClO4 >H2SO4 > H3PO4
C. 碱性:KOH < NaOH < Mg(OH)2 D. 还原性:F— > Cl— > Br—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中能大量共存的离子组是( )
A. OH-、HCO3-、Na+B. Cu2+、NH4+、OH-
C. Ba2+、K+、NO3-D. Ag+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四物质有如下转化关系(反应条件和部分产物已略去):A![]() B
B![]() C
C![]() D,回答下列问题:
D,回答下列问题:
(1)若A为气态氢化物和D能通过化合反应生成一种盐,则
①写出实验室制取A的化学方程式:______________________________________;
②写出由A生成B的化学方程式:______________________________________;
③某同学用干燥的圆底烧瓶收集一瓶A气体,用滴入酚酞的水做喷泉实验,能观察到美丽的红色喷泉。用方程式解释喷泉呈红色的原因:_____________________________________________。
(2)若A与B反应能生成一种淡黄色固体单质,写出该反应的化学方程式:_______________________。
(3)若A是金属单质,C是一种淡黄色固体,写出C生成D的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 2 mol SO2和1 mol O2在一定条件下充分反应后,混合物的分子数为2NA
B. 标准状况下,22.4 L NO2气体中所含分子数目为NA
C. 100 g 17%的氨水,溶液中含有的NH3分子数小于NA
D. 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产生活中广泛涉及氧化还原反应
Ⅰ.研究电化学腐蚀及防护的装置如图所示
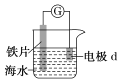
(1)若d为石墨,石墨上的电极反应式为_________________ ;
(2)若d为锌,锌上的电极反应式为___________________;
(3)将图中电流表换成外接电源,铁片接___________(填“正”或“负”)极被保护
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+ 6Na2O2![]() 2Na2FeO4+2Na2O+2Na2SO4+O2↑
2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中的氧化剂是________________,还原剂是_______________,每生成1 molNa2FeO4转移_______mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用_________________________________
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:____________________________。
②每生成1 mol FeO42-转移________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com