
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO、CuS、少量FeS和SiO2)中回收铍和铜两种金属的流程。

已知:Ⅰ.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]、=2.2×10-20、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Mn(OH)2]=2.l×10-13
(1)写出铍铜元件中SiO2与NaOH溶液反应的离子方程式______________________。
(2)滤渣B的主要成分为___________________(填化学式)。写出反应Ⅰ中含铍化合物与过量盐酸反应的化学方程式___________________________________________。
(3)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序________。
a.加入过量的NaOH b.过滤 c.加入适量的HCl
d.加入过量的氨水 e.通入过量的CO2 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是___________________________________。
(4)MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的离子方程式________________________________。
(5)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是___________(填离子符号)。
【答案】SiO2+2OH-=SiO32-+H2O CuS、FeS Na2BeO2+4HCl=BeCl2+2NaCl+2H2O dbfc 蒸发结晶时向溶液中持续通入HCl气体(或在HCl气流中加热蒸干) MnO2+CuS+4H+=S+Mn2++ Cu2++2H2O Fe3+
【解析】
(1)SiO2是酸性氧化物,和NaOH反应生成,硅酸钠和水;
(2)铍铜元件主要成分是BeO、CuS、FeS、SiO2,有信息可知BeO是两性氧化物,CuS、FeS不与NaOH反应,SiO2是酸性氧化物能和氢氧化钠反应,因此滤渣B的主要成分是CuS、FeS;滤液A中含铍化合物为Na2BeO2,写出Na2BeO2与过量的盐酸反应的化学方程式即可;
(3)①依据Be(OH)2和Al(OH)3性质相似,难溶于水及具有两性的特点,进行提纯BeCl2,
②BeCl2易发生水解,为得到BeCl2,应采取合理的方法抑制其水解;
(4)依据题所给信息,CuS中的S元素被氧化成S单质,同时MnO2中的Mn被还原成Mn2+,再依据化合价升降法配平,即可写出反应Ⅱ中CuS发生反应的离子方程式;
(5)溶液D中加入氨水,依据Ksp大小判断,可生成沉淀的三种离子顺序;
(1)SiO2是酸性氧化物,和NaOH反应生成,硅酸钠和水,离子方程式为:SiO2+2OH-=SiO32-+H2O;
本题答案为:SiO2+2OH-=SiO32-+H2O。
(2)铍铜元件主要成分是BeO、CuS、FeS、SiO2,由信息可知BeO是两性氧化物,CuS、FeS不与NaOH反应,SiO2是酸性氧化物能和氢氧化钠反应,因此滤渣B的主要成分是不反应的CuS、FeS;滤液A中含铍化合物为Na2BeO2,Na2BeO2与过量的盐酸反应的化学方程式为:Na2BeO2+4HCl=BeCl2+2NaCl+2H2O;
本题答案为:CuS、FeS,Na2BeO2+4HCl=BeCl2+2NaCl+2H2O。
(3)①依据Be(OH)2和Al(OH)3性质相似,难溶于水及具有两性的特点,在溶液C中加入过量的氨水,生成Be(OH)2沉淀,过滤后洗涤,再加入盐酸溶解即可,所以提纯BeCl2选择的合理步骤为:dbfc;
本题答案为:dbfc。
②BeCl2易发生水解,生成Be(OH)2和HCl,从BeCl2溶液中用蒸发结晶法得到BeCl2固体时,要抑制水解,所以操作为:蒸发结晶时向溶液中持续通入HCl气体(或在HCl气流中加热蒸干)
本题答案为:蒸发结晶时向溶液中持续通入HCl气体(或在HCl气流中加热蒸干) 。
(4)反应是在硫酸存在的条件下,MnO2和CuS反应,依据题所给信息,CuS中的S元素被氧化成S单质,同时MnO2中的Mn被还原成Mn2+,所以反应的离子方程式为:MnO2+CuS+4H+=S+Mn2++ Cu2++2H2O;
本题答案为:MnO2+CuS+4H+=S+Mn2++ Cu2++2H2O。
(5)当加入氨水时,依据Ksp[Cu(OH)2]=2.2×10-20,欲使Cu(OH)2沉淀,根据c(OH-)2![]() c(Cu2+)=2.2×10-20,即c(OH-)=1
c(Cu2+)=2.2×10-20,即c(OH-)=1![]() mol/L,时就有Cu(OH)2沉淀,同理可求欲使Fe3+、Mn2+转化为沉淀的c(OH-)分别为,1.7
mol/L,时就有Cu(OH)2沉淀,同理可求欲使Fe3+、Mn2+转化为沉淀的c(OH-)分别为,1.7![]() mol/L,1.45
mol/L,1.45![]() mol/L,因此首先沉淀的是Fe3+;
mol/L,因此首先沉淀的是Fe3+;
本题答案为:Fe3+。


科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1。请回答下列问题:
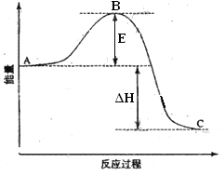
(1)图中A、C分别表示________、_________,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是_________________________。
(2)图中△H=____________kJ·mol-1。
(3)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=_________υ(SO3)=___________。
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 molSO3(g)的△H(要求写出计算过程)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列离子组的离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及的离子方程式 |
A | c(OH-)c(H+)=1酸性溶液中 | Fe2+、NO3-、Al3+、CO32- | 不能大量共存,3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
B | 由水电离出c(H+) =1×10-13mol·L-1 | K+、NH4+、Cl-、[Al(OH)4]- | 能大量共存 |
C | 有大量Fe3+的溶液 | Na+、NH4+、SO42-、Cl- | 能大量共存 |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O=2HClO+SO32- |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的一种重要方法,下列分类合理的是( )
A.K2CO3和Na2O都属于盐B.H2SO4和HNO3都属于酸
C.KOH和Na2CO3都属于碱D.Na2O和Na2SiO3都属于氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据叙述,写出下列反应的热化学方程式:
(1)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量。其热化学方程式为________。
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。其热化学方程式为______________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学式与指定物质的主要成分对应正确的是( )
A.Si—光导纤维B.NaHCO3—小苏打
C.CaCO3—熟石灰D.KAl(SO4)2·12H2O—绿矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是

A. 产生气体体积①=②
B. ①中阴极质量增加,②中正极质量减小
C. 溶液的pH变化:①减小,②增大
D. 电极反应式①中阳极:4OH-- 4e-= 2H2O+O2↑,②中负极:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质子数的2倍。据此回答下列问题:
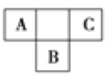
(1)A的气态氢化物的化学式为_________。
(2)B的元素符号为__________,在周期表中位于___________________。
(3)C的单质的化学式为__________,其氢化物的水溶液可用于雕刻玻璃。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com