
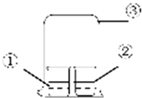
 用图中所示的装置进行实验,实验现象与预测不一致的是( )
用图中所示的装置进行实验,实验现象与预测不一致的是( )| ①中的物质 | ②中的物质 | 预测现象 | |
| A | 浓氨水 | FeCl3溶液 | ②中有红褐色沉淀 |
| B | 浓氨水 | 浓盐酸 | ③中有白烟 |
| C | 浓硝酸 | 淀粉KI溶液 | ②中溶液为蓝色 |
| D | 饱和亚硫酸溶液 | 蓝色石蕊试液 | ②中溶液先变红又褪色 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
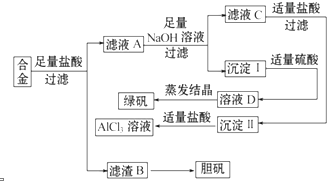 某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4?7H2O)和胆矾晶体(CuSO4?5H2O),其实验方案如下:
某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4?7H2O)和胆矾晶体(CuSO4?5H2O),其实验方案如下:查看答案和解析>>
科目:高中化学 来源: 题型:
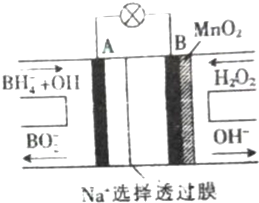
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、OCS中S的化合价为+4价 |
| B、羰基硫分解时,CO是氧化产物 |
| C、每有1mol OCS分解,能生成22.4LCO |
| D、OCS中含有共价键,属于非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2S水溶液呈酸性:H2S=H++HS- |
| B、醋酸钠溶液和硫酸氢钠混合:CH3COO-+H+=CH3COOH |
| C、向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3+H2O |
| D、碳酸钠溶液呈碱性:CO32-+2H2O?H2CO3+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用工业酒精(含甲醇)兑制饮用酒 |
| B、用食醋除去水壶内壁的水垢 |
| C、用甲醛溶液浸泡海产品进行防腐保鲜 |
| D、在不通风、无防护的条件下做实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
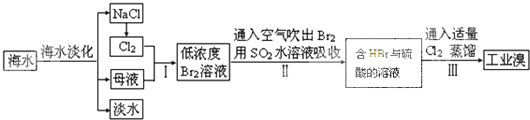
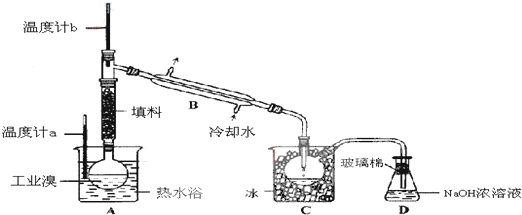
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com