
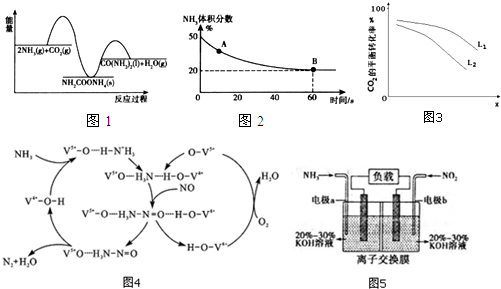
���� ��1����������ͼ���Է�����2NH3��g��+CO2��g��?CO��NH2��2��I��+H2O��I��Ϊ���ȷ�Ӧ�����ԡ�H��0��2NH3��g��+CO2��g��?NH2COONH4��s��Ϊ���ȷ�Ӧ�����ԡ�H1
��0�����ҡ�H1����H��0��NH2COONH4��s��?CO��NH2��2��I��+H2O��I��Ϊ���ȷ�Ӧ�����ԡ�H2��0���ݴ˷�����
��2����ͼ��������������������50%�仯Ϊ20%������������ֲ��䣬˵��B�㷴Ӧ�ﵽƽ��״̬��A�㰱������ٷֺ�������B�İ�������ٷֺ�����˵����Ӧ������дﵽƽ��״̬��A�������Ӧ���ʴ���B�������Ӧ���ʣ�
�ڵ���Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��ٸı䣬�ɴ�������һЩ������Ҳ���䣬�Դ˽����жϣ�
�۸���ͼ2��֪��CO2��NH3�����������ռ50%������ʼCO2��NH3��Ϊamol��ת���Ķ�����̼Ϊbmol��
2NH3��g��+CO2��g��?CO��NH2��2 ��l��+H2O ��g����
��ʼ a a 0
ת�� 2b b b
ƽ��a-2b a-b b
��ͼ��֪��$\frac{a-2b}{a-2b+a-b+b}$=20%������a=$\frac{8}{3}$b���ݴ˼����ƽ��ʱ�����������������ٸ���ƽ�ⳣ��Kp=$\frac{p��{H}_{2}O��}{{p}^{2}��NH{\;}_{3}��p��CO{\;}_{2}��}$���㣻
�ܸ÷�ӦΪ���������С�ķ�Ӧ���������ѹǿ��ת���ʴݴ��жϣ�
��3������ͼ��֪����NH3�ѳ������� NO��ԭ���У����Ļ��ϼۺ����������Ļ��ϼ۶����ͣ��ݴ��жϣ�
��4����Ӧ8NH3+6NO2�T7N2+12H2O����ԭ����У������ǻ�ԭ���ڸ�������������Ӧ��������������������������������ԭ��Ӧ���ݴ˴��⣮
��� �⣺��1����������ͼ���Է�����2NH3��g��+CO2��g��?CO��NH2��2��I��+H2O��I��Ϊ���ȷ�Ӧ�����ԡ�H��0��2NH3��g��+CO2��g��?NH2COONH4��s��Ϊ���ȷ�Ӧ�����ԡ�H1��0�����ҡ�H1����H��0��NH2COONH4��s��?CO��NH2��2��I��+H2O��I��Ϊ���ȷ�Ӧ�����ԡ�H2��0�����ԡ�H2����H����H1��
�ʴ�Ϊ����H1����H����H2��
��2���ٰ��������������50%�仯Ϊ20%������������ֲ��䣬˵��B�㷴Ӧ�ﵽƽ��״̬��A�㰱������ٷֺ�������B�İ�������ٷֺ�����˵����Ӧ������дﵽƽ��״̬��A�������Ӧ���ʴ���B�������Ӧ���ʣ���v����CO2����v����CO2����
�ʴ�Ϊ������
��a��NH3��CO2��H2O�ķ�����֮������ʼ�ĸ����ʵ����ʵ����йأ�����NH3��CO2��H2O�ķ�����֮��Ϊ2��1��1�����жϷ�Ӧ�Ƿ���ƽ��״̬����a����
b���÷�ӦΪ���������С�ķ�Ӧ����Ӧ������ѹǿ��С�����Ե�ѹǿ����ʱ��˵����Ӧ����ƽ��״̬����b��ȷ��
c����λʱ��������1mol CO2ͬʱ����2mol NH3��˵�����淴Ӧ������ȣ����Է�Ӧ����ƽ��״̬����c��ȷ��
d��2v����NH3��=v�棨H2O����˵���淴Ӧ���ʴ��� ����Ӧ���ʣ�������δ����ƽ��״̬����d����
��ѡ��bc��
�۸���ͼ2��֪��CO2��NH3�����������ռ50%������ʼCO2��NH3��Ϊamol��ת���Ķ�����̼Ϊbmol��
2NH3��g��+CO2��g��?CO��NH2��2 ��l��+H2O ��g����
��ʼ a a 0
ת�� 2b b b
ƽ��a-2b a-b b
��ͼ��֪��$\frac{a-2b}{a-2b+a-b+b}$=20%������a=$\frac{8}{3}$b������ƽ��ʱCO2��NH3��H2O����������ֱ�Ϊ50%��20%��30%��ƽ�ⳣ��Kp=$\frac{p��{H}_{2}O��}{{p}^{2}��NH{\;}_{3}��p��CO{\;}_{2}��}$=
$\frac{10��30%}{��{10��20%��}^{2}��10��50%}$=0.15��
�ʴ�Ϊ��0.15��
����ͼ��֪��XԽ��ת����Խ�ͣ��÷�Ӧ����ӦΪ���������С�ķ�Ӧ���������ѹǿ��������̼��ת���ʴ�����X��ʾ�¶ȣ��¶����ߣ�ת�����½���ƽ�������ƶ�������ѹǿ��ת���ʴ�����L1��L2��
�ʴ�Ϊ���¶ȣ�L1��L2���÷�Ӧ����ӦΪ���������С�ķ�Ӧ������ѹǿ��������̼��ת���ʴ�
��3��������ͼ��֪����NH3�ѳ������� NO��ԭ���У����Ļ��ϼۺ����������Ļ��ϼ۶����ͣ�����������ΪNO��O2��
�ʴ�Ϊ��NO��O2��
��4����Ӧ8NH3+6NO2�T7N2+12H2O����ԭ����У������ǻ�ԭ���ڸ�������������Ӧ������aΪ�������缫��ӦʽΪ2NH3-6e-+60H-=N2+6H2O��������������������������������ԭ��Ӧ������bΪ������
�ʴ�Ϊ������2NH3-6e-+60H-=N2+6H2O��
���� ���⿼�黯ѧ��Ӧ���ʡ���ѧƽ����ƶ�ԭ����������ԭ��Ӧ��ԭ��صĵ缫��Ӧ��֪ʶ���ۺ��Խϴ��Ѷ��еȣ�


 ���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ���йط�����ȷ���ǣ�������
���йط�����ȷ���ǣ�������| A�� | һ�ȴ��ﹲ��7�� | B�� | ����������̼ԭ��һ����ͬһƽ�� | ||
| C�� | ��  ��Ϊͬ���칹�� ��Ϊͬ���칹�� | D�� | 1mol����ϩ��H2��Ӧ�������4mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
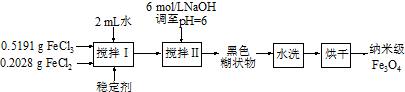
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�Ӻ�������Ų�--Ԫ�������ڱ��е�λ�� | |
| B�� | ������ʵ����ǿ��--���볣���Ĵ�С | |
| C�� | ���Ӽ��������Ĵ�С--�����ȶ��Եĸߵ� | |
| D�� | �����ڲ����������--��ѧ��Ӧ����ЧӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ | B�� | ��ԭ�� | ||
| C�� | ��������������ԭ�� | D�� | �������������л�ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����������������������ͣ�
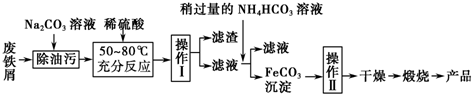
����������������������ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com