
【题目】具有相同电子层数的![]() 、
、![]() 、
、![]() 三种元素,已知它们最高价氧化物的水化物的酸性强弱顺序是
三种元素,已知它们最高价氧化物的水化物的酸性强弱顺序是![]() ,则下列判断正确的是( )
,则下列判断正确的是( )
A.原子半径:![]()
B.元素的非金属性:![]()
C.气体氢化物的稳定性:![]()
D.阴离子的还原性:![]()
【答案】B
【解析】
X、Y、Z三种元素的原子具有相同电子层数,应为同一周期元素,它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则X的最外层电子数为7,Y的最外层电子数为6,Z的最外层电子数为5,为非金属,原子序数X>Y>Z,根据同一周期元素的性质变化规律分析解答。
根据上述分析,Z、Y、X是同一周期,从左到右依次排列的三种元素,它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4。
A.同周期,从左到右,原子半径减小,则原子半径为X<Y<Z,故A错误;
B.它们最高价氧化物的水化物的酸性强弱顺序是HXO4>H2YO4>H3ZO4,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以非金属性:X>Y>Z,故B正确;
C.元素的非金属性越强,对应的氢化物的稳定性越强,非金属性:X>Y>Z,则气态氢化物稳定性:X>Y>Z,故C错误;
D.元素的非金属性越强,对应的阴离子的还原性越弱,非金属性:X>Y>Z,所以阴离子的还原性:X<Y<Z,故D错误;
故选B。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:

(1)反应开始至2min,以气体Z表示的平均反应速率为_________.
(2)该反应的化学方程式为_________.
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:此时体系的压强是开始时的_________倍;达平衡时,容器内混合气体的平均相对分子质量比起始投料时_________(填"增大""减小"或"相等").
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Deacon法制备Cl2的反应为4HCl(g)+O2(g)2Cl2(g)+2H2O(g)。如图为恒容容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系。下列说法正确的是( )
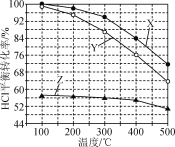
A.反应4HCl(g)+O2(g)2Cl2(g)+2H2O(g)的ΔH>0
B.Z曲线对应进料浓度比c(HCl)∶c(O2)=7∶1
C.400 ℃,进料浓度比c(HCl)∶c(O2)=4∶1时,O2平衡转化率为19%
D.400 ℃,进料浓度比c(HCl)∶c(O2)=1∶1时,c起始(HCl)=c0 mol·L-1,平衡常数K=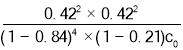
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最高的金属元素,化学性质活泼。
(1)在通常情况下,金属铝制品能稳定地存在,不被氧化且不跟水作用,是因为______
(2)将在空气中长时间放置的铝条浸入6mol/L的氢氧化钠溶液中,发现刚开始没有气泡,后来出现大量气泡。出现这一现象的原因是(用文字和方程式表述)____________
(3)明矾是常见的净水剂,写出明矾净水的原因(用文字和方程式表述)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升。下列分析错误的是

A.Al和O2化合放出热量B.硝酸汞是催化剂
C.涉及了:2Al+3Hg2+→2Al3++3HgD.“白毛”是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:
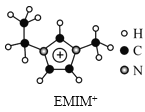
(1)碳原子价层电子的轨道表达式为__,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为__形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是__。NH3比PH3的沸点高,原因是__。
(3)氮元素的第一电离能比同周期相邻元素都大的原因是__。
(4)EMIM+离子中,碳原子的杂化轨道类型为__。分子中的大π键可用符号Π![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π![]() ),则EMIM+离子中的大π键应表示为__。
),则EMIM+离子中的大π键应表示为__。
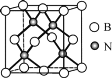
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于__晶体,其中硼原子的配位数为__。已知:立方氮化硼密度为dg/cm3,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为__(列出化简后的计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理电池废料以节约资源、保护环境。钴酸锂电池正极材料主要含有LiCoO2、导电剂乙炔黑、铝箔及镀镍金属钢壳等,处理该废旧电池的一种工艺如下图所示:
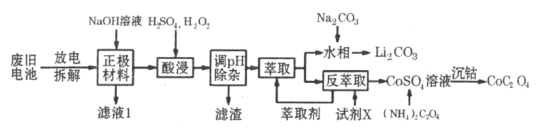
回答下列问题:
(1)Li原子结构示意图为_______,LiCoO2中Co的化合价是__________。
(2)用NaOH溶液处理正极材料的离子方程式为____________________________。
(3)“酸浸”过程中LiCoO2发生反应的离子方程式为___________________________。保持其他因素不变的情况下,“酸浸”时Co、Li元素的浸出率随温度的变化如右图所示,当温度高于80℃时Co元素浸出率下降的原因有:
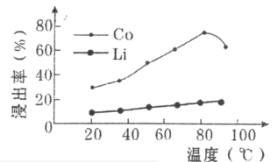
①Co2+水解加剧;②________________________________。
(4)调节pH的目的是使Ni2+和_______________(填离子符号)全部沉淀。
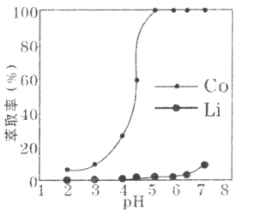
(5)“萃取”环节,钴、锂萃取率与平衡时溶液pH的关系如下图所示,为了实现钴、锂分离效果较好,pH一般选择______________(填整数)左右。
(6)“萃取”和“反萃取”可简单表示为![]() ,则反萃取过程中加入的试剂X是___________________________(填名称)。
,则反萃取过程中加入的试剂X是___________________________(填名称)。
(7)取CoC2O4固体4.41g在空气中加热至300℃,得到钴的氧化物2.41g和一种无毒无污染的气体,则该反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现一定量的铁铝合金与很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液![]() 中,逐滴加入
中,逐滴加入![]() 的氢氧化钠溶液,所加氢氧化钠溶液的体积(
的氢氧化钠溶液,所加氢氧化钠溶液的体积(![]() )与产生的沉淀的物质的量(mol)的关系如下图所示,则下列有关计算和判断正确的是( )
)与产生的沉淀的物质的量(mol)的关系如下图所示,则下列有关计算和判断正确的是( )
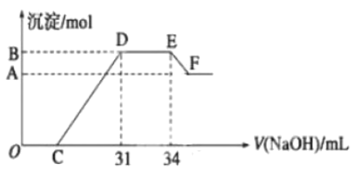
A.溶液![]() 中所含的阳离子有:
中所含的阳离子有:![]() 、
、![]() 、
、![]() 、
、![]()
B.在![]() 段,发生反应的离子方程式为
段,发生反应的离子方程式为![]()
C.无法求出![]() 点对应的沉淀的物质的量
点对应的沉淀的物质的量
D.![]() 点对应的氢氧化钠溶液的体积为
点对应的氢氧化钠溶液的体积为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行如下实验,能达到实验目的的是

A. 瓶中盛满水,从B口进气,用排水法收集HCl气体
B. 瓶中盛适量浓硫酸,从A口进气来干燥NH3
C. 从B口进气,用排空气法收集CO2
D. 瓶中盛满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com