
A、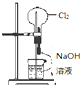 . .挤压胶头滴管后会看到烧瓶中形成喷泉 |
B、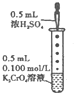 滴加几滴浓H2SO4后,溶液颜色由黄色变为橙色 |
C、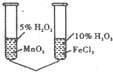 由该实验可以验证催化剂的催化效果 |
D、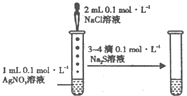 能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |


科目:高中化学 来源: 题型:
| A、Fe3++3OH-═Fe(OH)3 |
| B、Zn+Cu2+═Zn2++Cu |
| C、2H2O2═2H2O+O2 |
| D、2H2S+SO2═3S+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由三氯化铁到氢氧化铁胶体未发生化学变化 |
| B、FeCl3溶液与Fe(OH)3胶体中分散质颗粒的直径相同 |
| C、可以用丁达尔效应实验有效鉴别三氯化铁溶液和氢氧化铁胶体 |
| D、三氯化铁可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、78g Na2O2晶体中离子总数为4NA |
| B、常温下,2L、1 mol?L-1的乙酸溶液中,所含分子总数小于2NA |
| C、标准状况下,5.6L NO和5.6 L O2组成的混合气体中所含原子数为NA |
| D、对于反应:C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)△H=-1300 kJ/mol,有2NA个碳氧双键形成时,放出1300 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
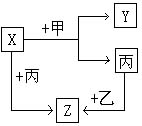 如图所示,甲、乙、丙、是三种常见单质,x、y、z是常见的三种化合物,它们之间有如下转化关系:
如图所示,甲、乙、丙、是三种常见单质,x、y、z是常见的三种化合物,它们之间有如下转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:
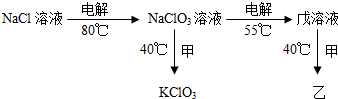 氯元素的常见化合价有-1,0,+1,+3,+4,+5,+7.
氯元素的常见化合价有-1,0,+1,+3,+4,+5,+7.| 生成物的实际产量 |
| 理论产量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com