
 CH3OH(g).6s后测得容器内生成CH3OH的2mol,求:
CH3OH(g).6s后测得容器内生成CH3OH的2mol,求: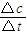 计算v(CH3OH),再根据速率之比等于化学计量数之比计算v(H2);
计算v(CH3OH),再根据速率之比等于化学计量数之比计算v(H2);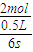 =
= mol/(L?s),
mol/(L?s), mol/(L?s)=
mol/(L?s)= mol/(L?s),
mol/(L?s), mol/(L?s);
mol/(L?s);

科目:高中化学 来源: 题型:
 CH3OH(g).6s后测得容器内生成CH3OH的2mol,求:
CH3OH(g).6s后测得容器内生成CH3OH的2mol,求:查看答案和解析>>
科目:高中化学 来源:2010年厦门双十中学高三考前热身卷理科综合(化学) 题型:填空题
(15分)现有A、B、D、X、Y、Z六种元素,其原子序数依次递增。已知,B、D的氧化物都是汽车尾气的主要有害成分;A、Y是短周期非金属元素,其单质在常温下均为气体。两单质混合见光爆炸生成AY,AY溶液显强酸性。X、Z为常见金属元素,X的原子序数为Z的一半。Z与Y2和A Y溶液反应分别得ZY 3和ZY 2,烧碱溶液不能与Z单质反应,而能与X单质反应。请回答下列问题:
(1)Y的原子结构示意图为 ;X在周期表中的位置是 。
(2)D的氧化物也是空气质量预报的指标之一。汽车尾气中产生D的氧化物的化学反应方程式为 。
(3)写出X单质与NaOH溶液反应的离子方程式
。
(4)电浮选凝聚法是工业上采用的一种污水处理方法。右图是该方法处理污水的实验装置示意图(X、F金属单质作电极)。实验过程中,污水的pH始终保持在5.0~6.0之间。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的沉淀具有吸附性,吸附污物而沉积,起到凝聚净化作用。阳极的电极反应有两个,分别是4OH--4e-=2H2O +O2↑和 。阳极区生成沉淀的离子方程式是 。
(5)一定条件下,8mol X与3molZ的氧化物W恰好反应,则W的化学式为 ;指出X单质与F的氧化物反应的一种用途 。
(6)BA4是一种重要能源物质,右图是1.01×105Pa下,1 mol BA4燃烧生成稳定化合物过程中的能量变化示意图,其热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
现有A、B、D、X、Y、Z六种元素,其原子序数依次递增。已知,B、D的氧化物都是汽车尾气的主要有害成分;A、Y是短周期非金属元素,其单质在常温下均为气体。两单质混合见光爆炸生成AY,AY溶液显强酸性。X、Z为常见金属元素,X的原子序数为Z的一半。Z与Y2和A Y溶液反应分别得ZY 3和ZY 2,烧碱溶液不能与Z单质反应,而能与X单质反应。请回答下列问题:
(1)Y的原子结构示意图为 ;X在周期表中的位置是 。
 (2)D的氧化物也是空气质量预报的指标之一。汽车尾气中产生D的氧化物的化学反应方程式为 。
(2)D的氧化物也是空气质量预报的指标之一。汽车尾气中产生D的氧化物的化学反应方程式为 。
(3)写出X单质与NaOH溶液反应的离子方程式
。

(4)电浮选凝聚法是工业上采用的一种污水处理方法。右图是该方法处理污水的实验装置示意图(X、F金属单质作电极)。实验过程中,污水的pH始终保持在5.0~6.0之间。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的沉淀具有吸附性,吸附污物而沉积,起到凝聚净化作用。阳极的电极反应有两个,分别是4OH--4e-=2H2O +O2↑和 。阳极区生成沉淀的离子方程式是 。
(5)一定条件下,8mol X与3molZ的氧化物W恰好反应,则W的化学式为 ;指出X单质与F的氧化物反应的一种用途 。
(6)BA4是一种重要能源物质,右图是1.01×105Pa下,1 mol BA4燃烧生成稳定化合物过程中的能量变化示意图,其热化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com