
| △c |
| t |
| m |
| n |
 CO2 +NO,
CO2 +NO,| △c |
| t |
| 0.1mol/L |
| 2min |
| m |
| n |


科目:高中化学 来源: 题型:
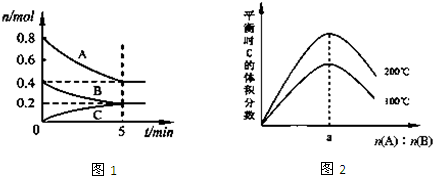
| A、200℃时,反应从开始到平衡的平均速率v(B)=0.04mol?L-1?min-1 |
| B、图2所知反应xA(g)+yB(g)?zC(g)的△H>0,且a=2 |
| C、若在图1所示的平衡状态下,再向体系中充入He,此时v正>v逆 |
| D、200℃时,向容器中充入2mol A和1mol B,达到平衡时,A的体积分数小于0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com