
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 6.8g液态KHSO4中含有0.1NA个阳离子 | |
| B. | NA个Fe(OH)3胶体粒子形成的纳米材料的质量为107g | |
| C. | 等体积等密度的N2和CO所含分子数相同 | |
| D. | 含NA个Na+的Na2O溶解于水1L水中,Na+的物质的量浓度为1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol | B. | 1.6mol | C. | 2.2mol | D. | 2.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
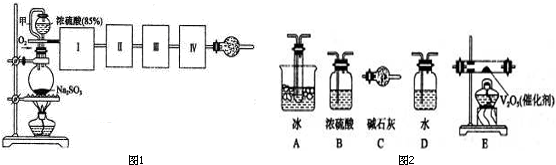
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)纯净物根据其组成和性质可进行如图分类:
(1)纯净物根据其组成和性质可进行如图分类:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH4( g )+4O2( g )═2CO2( g )+4H2O ( l )△H=+890 kJ/mol | |
| B. | CH4+2O2═CO2+H2O△H=-890 kJ/mol | |
| C. | CH4 ( g )+2 O2 ( g )═CO2 ( g )+2 H2O ( l )△H=-890 kJ/mol | |
| D. | $\frac{1}{2}$CH4 ( g )+O2 ( g )═$\frac{1}{2}$CO2 ( g )+H2O ( l )△H=-890 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2既是氧化剂又是还原剂 | |
| B. | NaN3中N元素被还原 | |
| C. | 还原产物与氧化产物质量之比为l:15 | |
| D. | 每生成16molN2转移30mole |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 3:1 | B. | 2:1 | C. | 4:1 | D. | 1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com