
分析 溶质的物质的量浓度C=$\frac{n}{V}$;
溶液的pH值计算公式为:pH=-lg[H+],结合Kw=[H+][OH-]计算溶液pH值;
依据溶液稀释过程溶质的物质的量不变计算,稀释溶液需要加入水、氢氧化钠、盐酸的体积.
解答 解:0.04g氢氧化钠的物质的量为$\frac{0.04g}{40g/mol}$=0.001mol,溶于水配制成100mL溶液物质的量浓度C=$\frac{0.001mol}{0.1L}$=0.01mol/L,氢氧化钠为强碱,则溶液中氢氧根离子浓度c(OH-)=10-2mol/L,常温下Kw=10-14,依据Kw=[H+][OH-],C(H+)=$\frac{1{0}^{-14}}{1{0}^{-2}}$=10-12(mol/L),则溶液pH=-lg10-12=12;
要使它的pH降为11,设需要加入蒸馏水体积为V,则依据溶液中氢离子物质的量不变得:10-12mol/L×100mL=10-11mol/L×(100+V),解得V=900mL;
若加入pH为10的NaOH溶液,设需要加入氢氧化钠体积为a,则依据溶液中氢氧根离子的物质的量不变得:10-2mol/L×100mL+10-4mol/L×a=10-3mol/L×(a+100)
,解得a=1000mL;
若加入0.01mol•L-1的盐酸,则先发生酸碱中和,设需要盐酸的体积为b,则依据溶液中氢氧根物质的量不变得:10-2mol/L×100-10-2mol/L×b=10-3mol/L×(100+b),解得b=81.8mL;
故答案为:0.01mol/l;12;900;1000;81.8.
点评 本题考查了有关物质的量浓度、溶液pH值的计算,熟悉计算公式是解题关键,注意稀释过程中溶质的物质的量不变,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: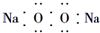 | |
| B. | 碳正离子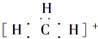 中质子数与电子数的比值为3:2 中质子数与电子数的比值为3:2 | |
| C. | 硫离子的结构示意图: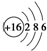 | |
| D. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
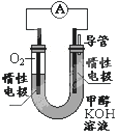 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.
甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
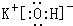 .
.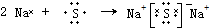 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数 | |
| B. | 在二氧化硅晶体中,围成最小环的原子数 | |
| C. | 在金刚石晶体中,围成最小环的原子数 | |
| D. | 在CsCl晶体中,与一个Cs+最近的且距离相等的Cs+的个数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| B. | 第ⅥA族元素中,气态氢化物稳定性最好的其单质氧化性也最强 | |
| C. | 同周期非金属氧化物对应水化物的酸性从左到右依次增强 | |
| D. | 第二周期元素的最高化合价为+1→+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5mol•L-1•s-1 | B. | v(D)=0.2mol•L-1•s-1 | ||
| C. | v(C)=0.25mol•L-1•s-1 | D. | v(B)=0.3mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com