(2011?临沂模拟)A、B、C、D、E为原子序数依次增大的五种短周期元素.E元素最高正价与最低负价的代数和为6,C单质既可与盐酸反应又可与NaOH溶液反应,C、E属同一周期,且能形成1:3型化合物;B原子的最外层电子数比次外层电子数多3;A、D原子序数相差8;若用A、B、D三种元素最高价氧化物分别与足量NaOH溶液反应,在得到的溶液中加入过量稀盐酸,只有一种溶液中能析出白色沉淀Y.
(1)写出E元素和钾元素形成的化合物的化学式
KCl
KCl
.
(2)C的氧化物与氢氧化钠溶液反应的离子方程式为
Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
.
(3)将红热的A单质投入到B的最高价氧化物对应水化物浓溶液中发生反应的化学方程式为
C+4HNO
3(浓)
CO
2↑+4NO
2↑+2H
2O
C+4HNO
3(浓)
CO
2↑+4NO
2↑+2H
2O
.
(4)生成白色沉淀Y的离子方程式为
SiO32-+2H+=H2SiO3↓或(H2O+SiO32-+2H+=H4SiO4↓)
SiO32-+2H+=H2SiO3↓或(H2O+SiO32-+2H+=H4SiO4↓)
.
(5)在1molD的最高价氧化物形成的晶体中,含有共价键
4
4
mol.



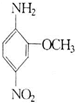 (2011?临沂模拟)2一氨基一5一硝基苯甲醚俗称红色基B,主要用于棉纤维织物的染色,也用于制金黄、枣红、黑等有机颜料,其结构简式如右所示.若分子式与红色基B相同,且氨基(-NH2)与硝基(-NO2)直接连在苯环上并呈对位时的同分异构体数目(包括红色基B)可能为( )
(2011?临沂模拟)2一氨基一5一硝基苯甲醚俗称红色基B,主要用于棉纤维织物的染色,也用于制金黄、枣红、黑等有机颜料,其结构简式如右所示.若分子式与红色基B相同,且氨基(-NH2)与硝基(-NO2)直接连在苯环上并呈对位时的同分异构体数目(包括红色基B)可能为( )