
【题目】在一个不导热的密闭反应器中,只发生两个反应:
a(g)+b(g)![]() 2c(g);△H1<0
2c(g);△H1<0
x(g)+3y(g)![]() 2z(g);△H2>0
2z(g);△H2>0
进行相关操作且达到平衡后(忽略体积改变所作的功),下列叙述错误的是
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
【答案】A
【解析】
试题分析:本题要特别注意题干中的信息“不导热的密闭反应器”。A项,等压时,通入惰性气体,气体的体积增大,平衡x(g)+3y(g)![]() 2z(g)(ΔH2>0)向左移动,反应放热,反应体系的温度升高,由于该反应容器是一个不导热的容器,所以平衡a(g)+b(g)
2z(g)(ΔH2>0)向左移动,反应放热,反应体系的温度升高,由于该反应容器是一个不导热的容器,所以平衡a(g)+b(g)![]() 2c(g)也向左(吸热方向)移动,c的物质的量减小,故A不正确;B项,等压时,通入z气体,增大了生成物的浓度,平衡x(g)+3y(g)
2c(g)也向左(吸热方向)移动,c的物质的量减小,故A不正确;B项,等压时,通入z气体,增大了生成物的浓度,平衡x(g)+3y(g)![]() 2z(g)向左移动,由于该反应的逆反应是放热反应,所以反应器的温度升高,B项正确;等容时,通入惰性气体,各反应物和生成物的物质的量没有变化,即各组分的浓度没有发生变化,所以各组分的反应速率不发生变化,C项正确;等容时,通入z气体,增大了生成物z的浓度,平衡逆向移动,所以y的物质的量浓度增大,D项正确,故选A。
2z(g)向左移动,由于该反应的逆反应是放热反应,所以反应器的温度升高,B项正确;等容时,通入惰性气体,各反应物和生成物的物质的量没有变化,即各组分的浓度没有发生变化,所以各组分的反应速率不发生变化,C项正确;等容时,通入z气体,增大了生成物z的浓度,平衡逆向移动,所以y的物质的量浓度增大,D项正确,故选A。


科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的物质,一定条件下它们的转化关系如下(副产物已略去).
A ![]() B
B ![]() C
C
试回答:
(1)若X为O2,则A不可能是______(填选项)
a.NH3 b.Mg c.S d.Si
(2)若A、B、C的水溶液均显碱性,焰色反应均为黄色,X为CO2,用离子方程式解释B溶液显碱性的原因____________________,举出C的一种用途_____________________
(3)若A是一种黄绿色气体单质,X是一种能使湿润的红色石蕊试纸变蓝的气体,反应①属于置换反应,写出反应①的化学方程式__________________C的水溶液中各离子浓度由大到小顺序为_______________________.
(4)若A为单质,C为红棕色气体。写出少量Fe粉与组成A物质的元素的最高价氧化物的水化物的稀溶液反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由2-氯丙烷制取少量的1,2-丙二醇时,需要经过下列哪几步反应( )
A.加成→消去→取代 B.消去→加成→水解
C.取代→消去→加成 D.消去→加成→消去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)zC(g),图1表示200℃时容器中A、B、C物质的量随时间的变化关系,图2表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
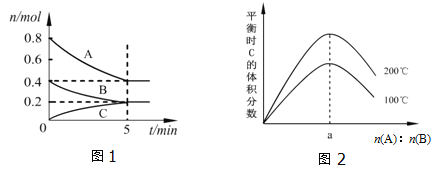
A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04molL﹣1min﹣1
B. 图2所知反应xA(g)+yB(g)zC(g)的△H>0,且a=1
C. 若在图1所示的平衡状态下,再向体系中充入He,此时v正>v逆
D. 200℃时,向容器中充入2mol A和1mol B,达到平衡时,A的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3 的混合液,经测定ClO-与ClO![]() 的物质的量浓度之比为1∶3,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为 ( )
的物质的量浓度之比为1∶3,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为 ( )
A. 21∶5 B. 11∶3 C. 3∶1 D. 4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.在离子化合物中不可能含有共价键
B.在共价化合物中也可能含有离子键
C.凡含有离子键的化合物一定是离子化合物
D.完全由非金属元素组成的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,属于氧化还原反应,且水既不作氧化剂又不作还原剂的是
A.2Na+2H2O=2NaOH+H2↑
B.2F2+2H2O=4HF+O2↑
C.CaO+H2O=Ca(OH)2
D.Cl2+H2O=HCl+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用2g块状大理石与30mL3mol/L盐酸反应制取CO2气体.若要增大反应速率,可采取的措施是
①再加入30mL3mol/L盐酸 ②改用30mL6mol/L盐酸
③改用2g粉末状大理石 ④适当升高温度
A.①②④ B.②③④ C.①③④ D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com