
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |

分析 (1)①温度越高,K越大,说明升高温度,平衡正移;
②K值很小,转化率很小;
③热化学方程式中,反应热=反应物的总键能-生成物的总键能,据此计算出断开1mol N-H键吸收的能量;
(2)合成氨反应为放热反应,升高温度,转化率减小;增大压强平衡正向移动,转化率增大;
解答 解:(1)①由表格数据可知,温度越高,K越大,说明升高温度,平衡正移,则正反应方向为吸热反应,故答案为:吸热;
②由表格数据可知,2000℃时,K=0.1,K值很小,则转化率很小,不适合大规模生产,所以人类不适合大规模模拟大气固氮,
故答案为:K值小,正向进行的程度小(或转化率低),不适合大规模生产;
③已知:N≡N键、H-H键的键能量为946kJ/mol、436kJ/mol,设N-H的键能为x,对于反应N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,反应热=反应物的总键能-生成物的总键能,故946kJ/mol+3×436kJ/mol-2×3×x=-92kJ/mol,解得:x=391kJ/mol;
故答案为:391 kJ/mol;
(2)合成氨反应为放热反应,升高温度,转化率减小,所以图A正确,B错误;该反应正方向为体积减小的方向,增大压强平衡正向移动,转化率增大,р2的转化率大,则р2大,р2>р1,
故答案为:A;р2>р1;
点评 本题考查了平衡常数的应用、合成氨反应的条件选择、影响化学平衡的因素、电解原理的应用、反应能量变化等,题目难度中等,侧重于基础知识的综合应用考查,注意把握K与温度的关系以及影响化学平衡的因素.


科目:高中化学 来源: 题型:选择题
| A. | 食品包装中的干燥剂必须用特别包装纸包装,其成分多为氧化钙颗粒,也有硅胶颗粒 | |
| B. | 蛋白质、塑料、合成橡胶、光导纤维都是高分子化合物 | |
| C. | Fe2O3、CuO、PbO等金属氧化物是我国古代就已经使用的用于烧碱釉陶的彩色釉面原料 | |
| D. | 控制汽车尾气、工业尾气、建筑扬尘、垃圾焚烧等的任意排放是治理雾霾天气重要环节 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
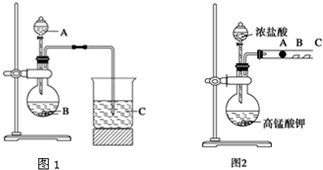
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
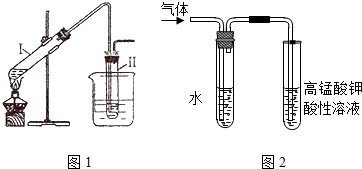
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 原子半径:T>Q>R | |
| C. | 最高价氧化物对应水化物的酸性:Q<W | |
| D. | 含T元素的盐溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 那浮在试管中的液面上 | B. | 钠沉入试管底部 | ||
| C. | 钠燃烧起来 | D. | 钠处于煤油和水的交界处 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
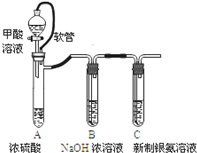 | 已知:①银氨溶液的化学式为: Ag(NH3)2OH ②反应结束后试管C底部有黑色 沉淀生成, ③分离出上层清液和底部黑色 固体备用. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象 | 解释或结论 |
| A | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中龠Na+,不含K+ |
| B | 向某溶液中滴加KSCN溶液,无明显现象,再滴加 少量氯水,溶液变成红色 | 溶液中含有Fe2+,没有Fe3+ |
| C | 向苯中滴入少量浓溴水,振荡,精置分层,上层呈橙红色,下层几乎无色 | 苯和溴水发生取代反应,使溴水褪色 |
| D | 在少量无水乙醇中加入金属Na+,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com