
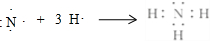
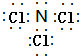
 .
. 分析 短周期元素M、A、B、C、D、E原子序数依次递增,M是元素周期表中原子半径最小的元素,则M为H元素;A原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故A为碳元素;B的单质为双原子分子,其氢化物能使湿润的石蕊试纸变蓝,则B为N元素;C在同周期元素中原子半径最大,处于IA族,原子序数大于氮,故C为Na;由原子序数可知D、E均处于第三周期,D的最外层电子数等于电子层数,E的最高正价是+7价,故D为Al,E为Cl,据此解答.
解答 解:短周期元素M、A、B、C、D、E原子序数依次递增,M是元素周期表中原子半径最小的元素,则M为H元素;A原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故A为碳元素;B的单质为双原子分子,其氢化物能使湿润的石蕊试纸变蓝,则B为N元素;C在同周期元素中原子半径最大,处于IA族,原子序数大于氮,故C为Na;由原子序数可知D、E均处于第三周期,D的最外层电子数等于电子层数,E的最高正价是+7价,故D为Al,E为Cl.
(1)E为Cl元素,在周期表中的位置:第三周期第VIIA族,故答案为:第三周期第VIIA族;
(2)A元素最高价氧化物为CO2,结构式为:O=C=O,故答案为:O=C=O;
(3)B的氢化物为NH3,用电子式表示形成过程: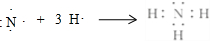 ,
,
故答案为: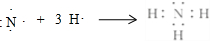 ;
;
(4)D的最高价氧化物为Al2O3,C的最高价氧化物对应的水化物为NaOH,二者反应生成偏铝酸钠与水,应的离子方程式是:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(5)B与E两元素形成的化合物,各原子均达8电子稳定结构,该化合物为NCl3,其电子式是: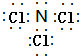 ,故答案为:
,故答案为: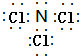 ;
;
(6)A与M形成的化合物N是重要的能源,N为CH4,与氯气发生取代反应,反应化学方程式:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,故答案为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;
(7))A与M形成的原子个数比为1:1的十二个原子的分子,其结构简式可能为 等,
等,
故答案为: 等.
等.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,注意掌握电子式表示物质或化学键的形成.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸溶液中含有亚硫酸、水、二氧化硫三种分子 | |
| B. | 用浓盐酸酸化高锰酸钾溶液,可增强高锰酸钾的氧化能力 | |
| C. | 铵盐受热都易分解,生成氨和相应的酸 | |
| D. | SiO2是酸性氧化物,能与氢氧化钠溶液反应,不与任何酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化都表现为热量的变化 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 反应是吸热还是放热必须看旧键断裂时吸收的能量和新键形成时释放的能量的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的原子序数依次增大 | |
| B. | X与Z形成的化合物为离子化合物 | |
| C. | X与Y形成的化合物只含共价键 | |
| D. | 存放Z单质的仓库失火不能用CO2灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氢氧燃料电池可以使用在航天飞机上,其工作原理如图所示.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其工作原理如图所示.下列有关氢氧燃料电池的说法不正确的是( )| A. | 该电池工作时化学能转化为电能 | |
| B. | 该电池的总反应为:2H2+O2═2H2O | |
| C. | 该电池中电极b是正极 | |
| D. | 外电路中电子由电极b通过导线流向电极a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
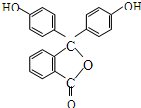
| A. | 酚酞的分子式是C20H12O4 | B. | 分子中的所有碳原子不在同一平面 | ||
| C. | 1mol酚酞最多可能消耗2mol NaOH | D. | 1mol酚酞可与10mol H2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焚烧树叶,以减少垃圾运输量 | |
| B. | 将废弃塑料就地烧掉,以消除“白色污染” | |
| C. | 加高工厂烟囱,以减少二氧化硫对环境的污染 | |
| D. | 运输沙土的车辆盖上苫布,以免增加空气中的粉尘含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
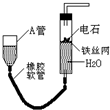 如图的实验装置可用于实验室中制取乙炔及成份检验.
如图的实验装置可用于实验室中制取乙炔及成份检验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com