
【题目】Ⅰ.氟及氟产品在工农业生产中应用非常广泛,回答下列问题:
(1)基态氟原子核外电子的运动状态有__种,氟原子的价电子排布图为__.
(2)与HF2- 互为等电子体的分子有___(写一个)。
(3)N2F2(二氟氮烯)分子中,氮原子的杂化轨道类型为__。
Ⅱ.下列变化中①NaCl 溶于水 ②HCl 溶于水 ③ 葡萄糖溶于水
④Na2O2溶于水 ⑤ I2升华 ⑥固体NaOH熔化。
未发生化学键破坏的是_____,仅发生离子键破坏的是________,仅发生共价键破坏的是_______,既发生离子键破坏,又发生共价键破坏的是____________(填序号)。
【答案】 9 ![]() CO2或N2O sp2 ③、⑤ ①、⑥ ② ④
CO2或N2O sp2 ③、⑤ ①、⑥ ② ④
【解析】Ⅰ.(1)基态氟原子核外含有9个电子,则其核外电子的运动状态有9种;氟原子的外围含有7个电子,其外围电子排布式为:2s22p5,价电子排布图为![]() ,故答案为:9;
,故答案为:9;![]() ;
;
(2)HF2- 的原子个数为3,价电子数目为16,与HF2- 互为等电子体的分子有CO2或N2O,故答案为:CO2或N2O;
(3)N2F2(二氟氮烯)分子中,氮原子形成了3个σ键和1个π键,则其杂化轨道类型为sp2,故答案为:sp2;
Ⅱ. ①NaCl 溶于水发生了电离,破坏了离子键;②HCl 溶于水电离成了氢离子和氯离子,破坏了共价键;③ 葡萄糖溶于水还是葡萄糖分子,化学键没有破坏;④Na2O2溶于水生成了氢氧化钠和氧气,破坏了离子键和共价键;⑤ I2升华后还是碘分子,化学键没有破坏;⑥固体NaOH熔化电离成了钠离子和氢氧根离子,破坏了离子键;未破坏化学键的是③⑤;仅离子键被破坏说明离子化合物溶于水或熔融或发生化学反应离子键被破坏,所以仅离子键被破坏的是①⑥,仅共价键被破坏说明共价化合物溶于水或发生化学反应,所以仅共价键被破坏的是②;既发生离子键破坏,又发生共价键破坏的是④,故答案为:③⑤;①⑥;②;④。


科目:高中化学 来源: 题型:
【题目】已知:25℃时,Kb(NH3·H2O)=1.8×10-5,该温度下,用0.100mol·L-1的氨水滴定10.00mL0.100mol·L-1的一元酸HA的溶液,滴定过程中加入氨水的体积(V)与溶液中lg![]() 的关系如右图所示。下列说法不正确的是
的关系如右图所示。下列说法不正确的是
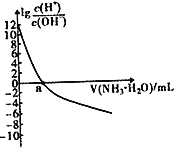
A. a=10 B. HA为强酸
C. 25℃时,NH4+的水解平衡常数为![]() ×10-9 D. 当滴入氨水的体积V=20mL时,溶液中存在c(NH4+)>c(A-)
×10-9 D. 当滴入氨水的体积V=20mL时,溶液中存在c(NH4+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Cl和Ba(OH)2反应是一个吸热反应,在反应过程中
A. 核能转化成热能
B. 化学能转化成热能
C. 生成物的总能量等于反应物的总能量
D. 生成物的总能量大于反应物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行以下实验:

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是__________(从下列仪器中选出所需仪器,用标号字母填写在空白处);
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_____________;
(3)写出步骤④的离子反应方程式(已知MnO2生成Mn2+和H2O )__________________ ;
(4)步骤⑤中,某学生选择用苯来提取碘的理由是______________________________ , 还可选用_____________________(写试剂的化学式)来提取碘,该步骤所用主要玻璃仪器的名称是__________________________。
(5)步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19,用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2A溶液的滴定曲线如图所示。下列说法不正确的是
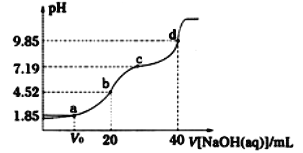
A. c点所得溶液中:c(A2-)=c(HA-)
B. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
C. A2-水解平街常数Kh(A2-)=10-7.19
D. a点所得溶液中,V0=10mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯气体有毒,常应用在果蔬保鲜方面,用NaClO3与CH3OH (沸点64.7℃) 在催化剂、61℃时发生反应得到ClO2,实验装置如下图,(已知ClO2 的稳定性较差,用稳定剂吸收ClO2。使用时加酸释放出ClO2)。完成下列填空:
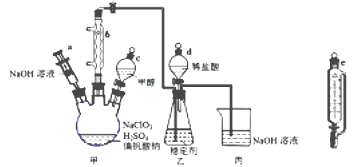
(1)仪器b的名称为________,其作用是_____________。
(2)反应中甲醇被氧化为甲酸(HCOOH),写出制备ClO2的化学方程式____________________。
(3)甲装置中采取的加热方式是________________,如果滴加甲醇的速度过快,可造成的后果____________。
(4)某同学建议将上述装置中的分液漏斗c改为恒压漏斗,你认为他的理由是______________________。
(5)实验结束后,先用仪器a 注入一定量的NaOH溶液,过一段时后再拆卸仪器,其目的是____________。
(6)下表是两种稳定剂加酸后释放ClO2的浓度随时间的变化数据,若将其用于樱桃保鲜,你认为效果较好的稳定剂是_______( 填"1”或“2”),原因是________________________________。
时间/天 稳定剂 | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
稳定剂1 | 80 | 150 | 80 | 20 | 10 | 5 | 0 | 0 | 0 |
稳定剂2 | 40 | 52 | 52 | 52 | 52 | 50 | 48 | 47 | 20 |
(7)某同学在实验室测定某保鲜剂中ClO2含量,其实验操作如下,在维形瓶中加入足量的KI溶液。再加入5mL稀硫酸,取15ml保鲜剂于锥形瓶中。ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+==2C1-+5I2+4H2O;用0.1000 mol/L Na2S2O3标准溶液滴定碘单质(I2+2S2O32-=2I-+S4O62-) 。达到滴定终点时用去18.00mlNa2S2O3标准溶液,测得该保鲜剂中ClO2的含量为________g·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性。常温下,0.1 molL-1 t溶液与0.1 molL-1 u溶液的pH 均为1。下列说法不正确的是

A. Y、W的最高价氧化物对应的水化物均为强酸
B. 元素的非金属性:Z>Y>X,原子半径:X<Z<Y
C. s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D. v的电子式可表示为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com