
分析 (1)依据c=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓盐酸体积,依据配制溶液体积选择合适规格的容量瓶;
(2)依据配制原理C=$\frac{n}{V}$可知,要想所配溶液浓度准确应保证溶质全部转移的到容量瓶;
(3)容量瓶为精密仪器,只有在标定温度下量取的体积才准确;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(5)错误操作导致实验失败且不能补救的必须重新配制.
解答 解:(1)密度为1.18g/mL,质量分数为36.5%浓盐酸物质的量浓度C=$\frac{1000×1.18×36.5%}{36.5}$=11.8mol/L,
设需要浓盐酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:V×11.8mol/L=0.1mol/L×250mL,解得V=2.1mL;配制250mL0.1mol/L的盐酸溶液,应选择250mL容量瓶;
故答案为:2.1;250ml;
(2)依据配制原理C=$\frac{n}{V}$可知,要想所配溶液浓度准确应保证溶质全部转移的到容量瓶,若不洗涤则会导致部分溶质不能转移到容量瓶,实验误差较大;
故答案为:保证溶质全部转入容量瓶;
(3)容量瓶为精密仪器,只有在标定温度下量取的体积才准确,所以稀释后,应冷却到室温;
故答案为:容量瓶盛放热溶液时,体积不准;
(4)若量取浓盐酸时,仰视刻度,导致量取的浓盐酸体积偏大,氯化氢的物质的量偏大,溶液浓度偏高;
若定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高;
故答案为:偏高;偏高;
(5)加蒸馏水时不慎超过了刻度,溶液体积偏大,无法补救,必须重新配制,故答案为:重新配制.
点评 本题考查了配制一定物质的量浓度的溶液方法,题目浓度中等,注意掌握配制一定物质的量浓度的溶液方法,明确误差分析的方法与技巧,试题培养了学生灵活应用所学知识的能力.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
| A. | 6.4g | B. | 6g | C. | 12.4g | D. | 8.8g |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:填空题
I.某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
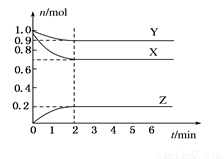
(1)该反应的化学方程式为_______________________。
(2)反应开始至2 min,气体Z的平均反应速率为____________。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的____________倍;
②若此时将容器的体积缩小为原来的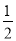 倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为____________反应(填“放热”或“吸热”)。
倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为____________反应(填“放热”或“吸热”)。
Ⅱ.某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应:4NO2(g)+O2(g) 2N2O5(g) ΔH<0的影响。
2N2O5(g) ΔH<0的影响。

(1)图像中T1和T2的关系是T1________T2(填“>”、“<”或“=”);
(2)比较a、b、c三点所处的平衡状态中,反应物NO2的转化率最大的是__________(填字母);
(3)若容器体积为1 L,n=1 mol,NO2的转化率为50%,则此条件下(T2),反应的平衡常数K=___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:实验题
(1)选择仪器。完成本实验所必需的仪器有:托盘天平 药匙、烧杯、玻璃棒、____________、____________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体____________g。
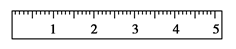
(3)称量。天平调平之后,应将天平的游码调至某个位置,请在下图中用一根 竖线标出游码左边缘所处的位置:
(4)将药品倒入烧杯中溶解、冷却。
(5)转移、洗涤。在转移时应使用玻璃棒引流,需要洗涤烧杯和玻璃棒2~3次是为了_____________
(6)定容、摇匀。
(7)将配好的溶液倒入指定的试剂瓶,并贴好标签,注明溶液名称及浓度。
(8)配制时下列操作会导致所配溶液浓度偏高的是________。
A.转移时有少量溶液溅出 | B.容量瓶用蒸馏水洗净后未干燥 |
C.定容时俯视读取刻度 | D.定容时液面超过了刻度线 |
E.称量NaCl时用了生锈的砝码
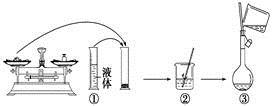
(9)下图是某同学在实验室配制该NaCl溶液的过程示意图,其中有错误的是_________(填操作序号)。
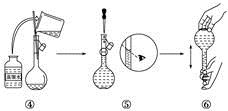
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在滴定操作中,滴定管和锥形瓶都需要用待装溶液润洗 | |
| B. | 酸性溶液中,Fe2+、SO2-4、K+、NO-3能大量共存 | |
| C. | SO2具有漂白性,将其通人石蕊溶液中,溶液先变红后褪色 | |
| D. | 常用丁达尔效应区分溶液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b>c>d | B. | b>a=d>c | C. | b>a>d>c | D. | c>a=d>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com