
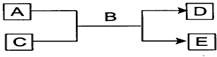
分析 (1)A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,为氯气与碱的反应;
(2)A为淡黄色固体,C为无色的气体,则A为Na2O2,C为O2,为A与盐酸等物质的反应;
(3)A、C、D均是铁的化合物,B是稀硫酸,则A为Fe3O4.
解答 解:I:(1)A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,为氯气与碱的反应,离子反应为Cl2+2OH-=Cl-+ClO-+H2O (或3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O),
故答案为:Cl2+2OH-=Cl-+ClO-+H2O (或3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O);
(2)A为淡黄色固体,C为无色的气体,则A为Na2O2,C为O2,为A与盐酸等物质的反应,离子反应为2Na2O2+4H+═O2↑+4Na++2H2O,
故答案为:2Na2O2+4H+═O2↑+4Na++2H2O;
(3)A、C、D均是铁的化合物,B是稀硫酸,则A为Fe3O4,A和B的反应为Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O,
故答案为:Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O.
点评 本题考查无机物的推断,侧重“A+B→C+D+H2O”反应的考查,把握元素化合物知识及物质的性质为解答的关键,注意利用题干信息及物质转化推断无机物,题目难度中等.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2CH3 | B. | 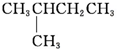 | C. |  | D. | 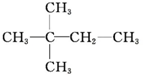 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
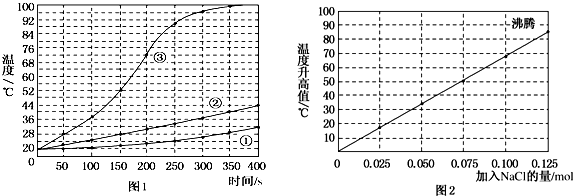
| A. | 等于5s | B. | 等于10s | C. | 小于10s | D. | 大于10s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池可在常温或高温时工作,对环境有较强的适应性 | |
| B. | 负极反应为H2+2OH--2e-=2H2O | |
| C. | 该电池工作时负极有CO2生成 | |
| D. | 该电池供应2molH2O,同时转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W | |
| T |
 (写电子式);
(写电子式);查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com