
分析 ①溶于水得无色澄清透明溶液,所以一定不含CuSO4、CaCO3;②取少量上述溶液滴加BaCl2溶液生成白色沉淀,再加盐酸沉淀溶解消失并产生无色气体,一定含有Na2CO3,一定不含FeCl3,但是KCl无法判断是否存在,据此回答.
解答 解:①溶于水得无色澄清透明溶液,所以一定不含CuSO4、CaCO3;②取少量上述溶液滴加BaCl2溶液生成白色沉淀,再加盐酸沉淀溶解消失并产生无色气体,一定含有Na2CO3,一定不含FeCl3,但是KCl无法判断是否存在.
(1)一定不存在的物质是CuSO4、CaCO3,故答案为:FeCl3、CuSO4、CaCO3;
(2)一定存在的物质是Na2CO3,故答案为:Na2CO3;
(3)可能存在的物质是KCl,故答案为:KCl;
(4)取少量上述溶液滴加BaCl2溶液生成白色沉淀,再加盐酸沉淀溶解消失并产生无色气体发生的反应有:Ba2++CO32-=BaCO3↓;2H++BaCO3=CO2↑+H2O+Ba2+;故答案为:Ba2++CO32-=BaCO3↓;2H++BaCO3=CO2↑+H2O+Ba2+.
点评 本题属于物质鉴别题,难度不大,解此类试题时要熟记常见物质的特殊反应现象,注意知识的迁移应用是关键.


科目:高中化学 来源: 题型:选择题
| A. | H2SO3>HI>Fe2+>NO | B. | HI>Fe2+>H2SO3>NO | ||
| C. | Fe2+>HI>H2SO3>NO | D. | NO>Fe2+>H2SO3>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
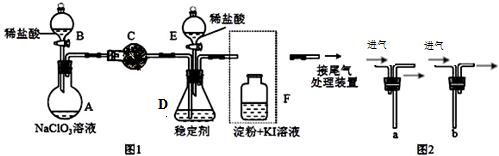

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
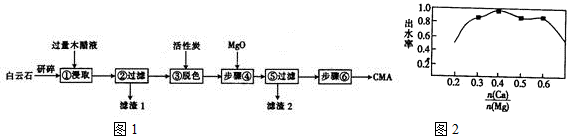
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,Y是地壳中含量最多的元素,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,Y是地壳中含量最多的元素,下列说法中正确的是( )| A. | 非金属性:X>Y | |
| B. | 原子半径:Z>W>X>Y | |
| C. | 氢化物的沸点:Z>Y | |
| D. | W的单质能水反应,生成一种具有漂白性的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼烧的铁丝在氯气中燃烧,集气瓶内充满棕黄色烟雾 | |
| B. | 氢气在氯气中燃烧,集气瓶口有白雾 | |
| C. | 向盛水的烧杯中先加入过氧化钠,再滴加酚酞,最终溶液呈红色 | |
| D. | 将一块钠放在燃烧匙中加热,燃烧后得到白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1溶液中:NH4+、K+、ClO-、Cl- | |
| B. | 在含有大量CO32-溶液中:NH4+、Na+、Cl-、H+ | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在强碱溶液中:Na+、K+、CO32-、SiO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com