
Cl2、漂白液(有效成分为NaClO)在生产、生活中广泛用于杀菌、消毒。
(1)电解NaCl溶液生成氯气的化学方程式为 。
(2)Cl2溶于H2O、NaOH溶液即获得氯水、漂白液。
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是 。
②25℃,Cl2与H2O、NaOH的反应如下:
反应Ⅰ | Cl2+H2O |
反应Ⅱ | Cl2+2OH- |
不直接使用氯水而使用漂白液做消毒剂的原因是 。
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+;ClO发生的电极反应式是 。
(4)研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的漂白液中NaClO的质量百分含量随时间变化如图所示:
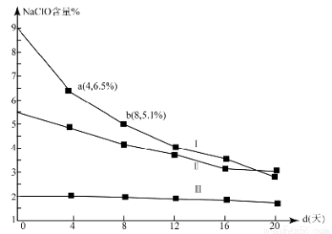
①分解速率v(Ⅰ) v(Ⅱ)(填“>”“<”或“=”),原因是 。
②NaClO分解的化学方程式是 。
③4d-8d,Ⅰ中v(NaClO)= mol/(L·d)(常温下漂白液的密度约为1g/cm3,且变化忽略不计)
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:选择题
下列叙述I和II均正确并有因果关系的是
选项 | 叙述I | 叙述II |
A | Na在Cl2中燃烧的生成物含离子键 | NaCl固体可导电 |
B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
C | 乙烯可与KMnO4溶液发生反应 | 乙烯具有还原性 |
D | 乙醇的沸点比乙酸的沸点高 | 乙醇和乙酸可通过蒸馏初步分离 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上9.4周考化学试卷(解析版) 题型:选择题
水玻璃在工业生产上具有重要的用途,在建筑等行业应用非常广泛。下列不是水玻璃用途的是( )
A.肥皂填料 B.木材防火剂 C.纸板黏合剂 D.制玻璃
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第五次周练化学试卷(解析版) 题型:实验题
[化学—选修2:化学与技术]
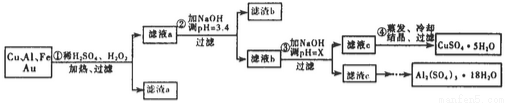
信息时代给人们的生活带来了极大的便利,但同时也产生了大量的电子垃圾。某化学兴趣小组将一批废弃的线路板简单处理后,得到了主要含Cu、Al及少量Fe、Au等金属的混合物,并设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:
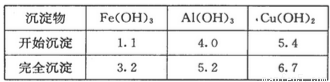
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)过滤操作中用到的玻璃仪器有___________。
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是____________。
(3)滤渣a的主要成分是_________________。
(4)步骤③中X的取值范围是____________________。
(5)为了测定硫酸铜晶体的纯度,该组甲同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI和淀粉指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定至终点。共消耗14.00mLNa2S2O3标准溶液。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①样品中硫酸铜晶体的质量分数为____________。
②该组乙同学提出通过直接测定样品中SO42-的量也可求得硫酸铜晶体的纯度,老师审核后予以否决,其原因是______________。
(6)请你设计一个由滤渣c得到Al2(SO4)3·18H2O的实验方案___________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第五次周练化学试卷(解析版) 题型:选择题
下列有机物同分异构体数目判断错误的是
选项 | 有机物 | 同分异构体数目 |
A | 分子式为C5H12 | 3 |
B | 分子式为C5H10,能使溴的四氯化碳溶液褪色 | 5 |
C | 分子式为C4H10O,能与Na反应生成氢气 | 4 |
D | 分子式为C4H8O2,能与NaHCO3反应 | 3 |
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第三次周练化学试卷(解析版) 题型:选择题
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | H2O/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol•L-1•mim-1
B.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,0.4molH2,则v(正)>v(逆)
D.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时n(CO2)=0.40mol
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三一模理综化学试卷(解析版) 题型:实验题
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上综合利用铝土矿的部分工艺流程如下。
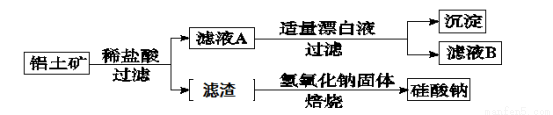
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+ = □Fe(OH)3↓+□C1-+ 。
(2)检验滤液B中是否还含有Fe2+的方法为: 。
(3)将滤液B中的铝元素以沉淀形式析出,选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
(4)由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
(5)滤渣的主要成分是 (填化学式),其与NaOH固体焙烧制备硅酸钠,可采用的装置为 (填代号),该反应的化学方程式是 。
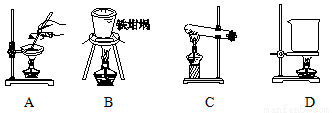
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第二次月考化学试卷(解析版) 题型:选择题
硼氢化钠(NaBH4)为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在干空气中稳定,在湿空气中分解,是无机合成和有机合成中常用的选择性还原剂。某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:

下列说法不正确的是
A.实验室中取用少量钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀
B.操作②、操作③分别是过滤与蒸发结晶
C.反应①加料之前需将反应器加热至100℃以上并通入氩气
D.反应①中氧化剂与还原剂的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第二次月考化学试卷(解析版) 题型:选择题
已知下面三个数据:①7.2×10 -4 ②2.6×10 -4 ③4.9×10 -10 分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO 2 ==HCN+NaNO 2 NaNO 2 +HF==HCN+NaF NaNO 2 +HF==HNO 2 +NaF
由此可判断下列叙述中正确的是( )
A.HF的电离常数是① B.HNO2 的电离常数是①
C.HCN的电离常数是② D.HNO2 的电离常数是③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com