
| A. | 100℃时水的离子积常数Kw为5.5×10-13,说明水的电离是放热反应 | |
| B. | 配制Fe(NO3)2溶液时,为了防止Fe2+水解可向溶液中加入适量的稀硝酸 | |
| C. | NaClO溶液中通入少量CO2,ClO-水解程度增大,溶液碱性增强 | |
| D. | 0.1 mol/L CH3COOH溶液加水稀释后,CH3COOH的电离程度和溶液中c(OH-)都增大 |
分析 A.升温水的电离被促进,电离过程是吸热过程;
B.硝酸具有强氧化性,能氧化+2价的铁;
C.二氧化碳与水反应生成碳酸,碳酸的酸性比次氯酸强;
D.加水稀释促进CH3COOH电离,溶液中CH3COOH个数减少、CH3COO-个数增加,溶液中氢离子浓度减小.
解答 解:A.100℃时水的离子积常数Kw为5.5×10-13,说明水电离出的氢离子和有关离子浓度增大,电离过程是吸热过程,故A错误;
B.配制Fe(NO3)2溶液时,为了防止Fe2+水解可增加氢离子,提高溶液酸性,Fe2++2H2O?Fe(OH)2+2H+,平衡逆向移动,抑制水解,故B错误;
C.二氧化碳与水反应生成碳酸,碳酸的酸性比次氯酸强,可以与NaClO反应生成HClO,溶液显示酸性,故C错误;
D.0.1 mol/L CH3COOH溶液加水稀释后,促进CH3COOH电离,溶液中CH3COOH个数减少,CH3COOH的电离程度增大,但溶液中氢离子浓度减小,温度不变,水的离子积常数不变,所以氢氧根离子浓度增大,故D正确;
故选D.
点评 本题考查水的电离、溶液的配制、电离平衡等知识,注意总结影响因素以及平衡移动的方向的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径大小:Z>X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>Z | |
| C. | W分别与Y、Z形成的化合物均易溶于水 | |
| D. | X的单质既能和酸反应,又能和碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a c f h | B. | a c e g | C. | a c e f h | D. | b d e h |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=3的醋酸与pH=11的氢氧化钠溶液等体积混合所得溶液的pH<7 | |
| B. | 反应2CO(g)+2H2(g)→CH3COOH (l)的△S>0 | |
| C. | 冰醋酸用水稀释,溶液中c(H+)先变大后变小 | |
| D. | 含有CH3COOH、C2H5OH、CH3COOC2H5及H2O的平衡体系中加入少量浓硫酸,CH3COOC2H5的物质的量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将汽油标准由“国IV”提到“国V”,以降低汽车尾气污染 | |
| B. | 积极推广太阳能、风能等新能源的使用,减少化石燃料的使用 | |
| C. | 加强城市生活污水脱氮除磷处理,遏制水体富营养化 | |
| D. | 加高烟囱,减少烟尘对周围环境的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验装置 | 现象 |
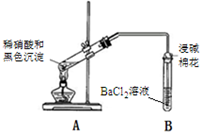 | 1A试管中黑色沉淀逐渐溶解 2A试管内上方出现红棕色气体 3B试管中出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气分子呈正四面体空间构型 | B. | CS2分子的结构式:S═C═S | ||
| C. | S2-的结构示意图: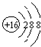 | D. | 氯化铵的电子式 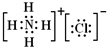 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com