
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(1)配制浓度为2 mol·L-1的NaOH溶液100 mL,用托盘天平称取NaOH固体时,天平读数将________(填写字母,下同)。
A.等于8.0 g B.等于8.00 g
C.大于8.0 g D.等于0.2 g
(2)某实验中需2 mol·L-1的Na2CO3溶液950 mL,配制时应选用的容量瓶的规格为____________,称取Na2CO3的质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(l)+3O2(g)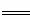 2CO2(g)+4H2O(g)
2CO2(g)+4H2O(g)  H1=-1275.6kJ·mol-1
H1=-1275.6kJ·mol-1
②2CO(g)+O2(g)  2CO2(g)
2CO2(g)  H2=-566.0kJ·mol-1
H2=-566.0kJ·mol-1
③H2O(g)=H2 O(l)
O(l)  H3=-44.0kJ·mol-1
H3=-44.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式 。
(2)生产甲醇的原料CO和H2来源于下列反应:
CH4(g)+H2O(g) CO(g)+3H2(g)
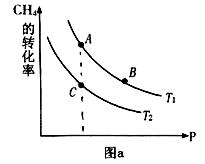
CO(g)+3H2(g) 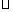 H>0
H>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则T1 T2(填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为 ;
②100℃时,将1 mol CH4和2 mol H2O通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。
a.容器的压强恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 molH2
c.容器内气体密度恒定
d.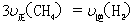
如果 达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K= 。
达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K= 。
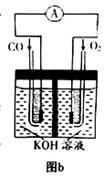
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
白磷(P4)是一种常见的晶体,可用于制备较纯的磷酸。
(1)已知白磷和氯酸溶液可发生如下反应:
P4 + HClO3 + === HCl + H3PO4
配平并完成上述反应方程式,该反应的氧化剂是______________。
(2)白磷有毒,有实验室可采用CuSO4溶液进行处理,其反应为:
11P4 + 60CuSO4 + 96H2O === 20Cu3P + 24 H3PO4 + 60 H2SO4
该反应的氧化产物是______________,若有1.1mol P4反应,则有________mol电子转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
由于用氯气对饮用水消毒,会使水中的有机物发生氯代,生成有机含氯化合物,于人体有害,世界环保联盟即将全面禁止这种消毒方法,建议采用广谱性具有强氧化性的高效消毒剂二氧化氯(ClO2).C102极易爆炸,生产和使用时尽量用稀有气体稀释,避免光照、震动或加热.
(1)在C102分子中,氯元素的化合价
(2)欧洲一些国家用NaClO3氧化浓盐酸来制 C102,同时有Cl2生成,且Cl2的体积为ClO2体积的一半,表示这一反应的化学方程式是 。
(3)我国广泛采用将经干燥空气稀释的氯气,通入有固体亚氯酸钠(NaClO2)的柱内制得C102,这一反应的学方程式是 ,和欧洲的方法相比,我国这一方法的主要优点是 。
(4)在酸性溶液中,用草酸钠(Na2C204)还原NaClO3也可制得C102,表示这一反应的离子方程式是 ,此法的优点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有M、N、P、E 4种元素的单质,能发生以下反应①在水溶液中,M+N2+===M2++N
②P+2H2O(冷)===P(OH)2+H2↑ ③N、E相连浸入稀H2SO4中,电极反应为:N-2e-===N2+,2H++2e-===H2↑ 判断它们的还原性由强到弱的顺序是 ( )
A.M、N、P、E B.P、M、N、E C.M、N、E、P D.E、P、M、N
查看答案和解析>>
科目:高中化学 来源: 题型:
从海水中可以提取溴,主要反 2Br-+Cl2=Br2+2C1-.下列说法正确的是 ( )
A.溴离子具有氧化性 B.氯气是还原剂
C.该反应属于复分解反应 D.氯气的氧化性比溴单质强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各反应中,氧化反应与还原反应在同种元素中进行的是( )
A.Cl2+2NaOH===NaCl+NaClO+H2O B.2KClO3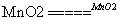 2KCl+3O2↑
2KCl+3O2↑
C.2KMnO4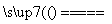 K2MnO4+MnO2+O2↑ D.2H2O
K2MnO4+MnO2+O2↑ D.2H2O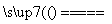 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
在新制的氯水中存在平衡:Cl2+H2O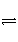
 H++Cl-+HClO,若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是( )
H++Cl-+HClO,若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是( )
A.H+浓度减小,HClO浓度减小
B.H+浓度增大,HClO浓度增大
C.H+浓度减小,HClO浓度增大
D.H+浓度增大,HClO浓度减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com