
下列叙述中不正确的是( )
A.目前,我国城市环境污染中的大气污染物主要是SO2、NO2、CO、烟尘
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
D.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知有以下物质相互转化。
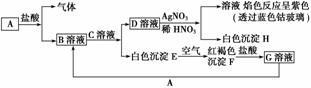
试回答下列问题:
(1)B的化学式为______________________,D的化学式为______________________。
(2)由E转变成F的化学方程式为___________________________________________。
(3)用KSCN鉴别G溶液的离子方程式为____________________________________;
向G溶液加入A的有关离子反应方程式为____________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
中共十八大报告提出:“大力推进生态文明建设”。
⑴向燃煤中加入石灰石作脱硫剂,可大大减少SO2的排放及酸雨的发生,用这种方法最终可将煤中的硫转化为 (填化学式)。
⑵自来水厂常用漂白粉、液氯、二氧化氯、臭氧等作为消毒剂,杀灭水中的细菌。液氯注入水中后,能杀死水中细菌,写出反应的化学方程式 。
⑶对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,转化为CO2和 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中的Cl-的物质的量与50 mL 1 mol ·L-1 MgCl2溶液中相等的是
A.150 mL 1 mol·L-1的NaCl溶液 B.75 mL 0.5mol·L-1的CaCl2溶液
C.50 mL 2 mol·L-1的KCl溶液 D.75 mL 1 mol ·L-1的FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的分离或提纯,应选用下述方法的哪一种?(填选项字母)
A.分液 B.过滤 C.萃取 D.蒸馏 E.蒸发结晶 F.高温分解
①分离CCl4和H2O: ;
②除去澄清石灰水中悬浮的CaCO3: ;
③除去CaO固体中少量的CaCO3固体: ;
④从碘水中提取碘: ;
⑤ 分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在指定的条件下,下列各组离子能大量共存的是( )
A.使甲基橙变红的溶液中:Fe2+、Na+、I-、NH4+
B.强碱性溶液中:K+、Na+、ClO-、S2-
C.0.1 mol·L-1 NaAlO2溶液中:H+、Na+、Cl-、SO42-
D.由H2O电离出的c(H+)=10-11mol/L溶液中:Na+、HCO3-、AlO2-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
双酚A作为食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大。下列有关双酚A的叙述不正确的是( )
A.双酚A的分子式是C15H16O2
B.双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3
C.反应①中,1mol双酚A最多消耗2 mol Br2
D.反应②的产物中只有一种官能团
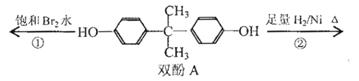
查看答案和解析>>
科目:高中化学 来源: 题型:
有人建议将氢元素排在元素周期表的第ⅦA族。下列事实能支持这一观点的是( )
①氢原子得到一个电子后最外层电子达到稳定结构 ②氢分子的结构式为H—H
③与碱金属元素形成离子化合物M+[∶H]- ④分子中原子间的化学键都属于非极性键
A.①②③ B.①③④ C.②③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s)2Ca2++2K++Mg2++4SO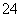 +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
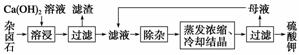
(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:____________
____________________________________________________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入__________溶液调滤液pH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系见下图。由图可得,随着温度升高,①____________ ____,②__________________。
____,②__________________。

(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+ CO
CO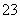 CaCO3(s)+SO
CaCO3(s)+SO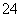
已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com